FISIOLOGIA NORMALE
La funzione principale dell’emoglobina, la consegna di ossigeno dai polmoni alle cellule dei tessuti, dipende dall’affinità variabile che l’emoglobina ha per l’ossigeno.
Questa affinità dipende principalmente dalla pressione parziale locale dell’ossigeno (pO2), ma anche il pH, la pressione parziale dell’anidride carbonica (pCO2) e la concentrazione di fosfati organici sono significativi.,
Le condizioni locali nei polmoni (pO2 relativamente alto, pCO2 basso, ecc.) sono associate ad alta affinità, in modo che l’emoglobina leghi prontamente l’ossigeno qui; il prodotto di questo legame è l’ossiemoglobina.
Al contrario nella microvascolatura dei tessuti, le condizioni locali (pO2 relativamente basso, pCO2 alto, ecc.) sono associate a una bassa affinità dell’emoglobina per l’ossigeno e l’ossiemoglobina si dissocia prontamente, rilasciando ossigeno alle cellule dei tessuti.,
Ferro eme-il sito di legame dell’ossigeno
La molecola dell’emoglobina adulta (HbA) comprende quattro catene polipeptidiche piegate (due alfa e due beta), ognuna delle quali ha un gruppo eme porfirina attaccato . Al centro di ciascuno dei quattro gruppi eme c’è un atomo di ferro nello stato ferroso (Fe2+).
Questi quattro atomi di ferro sono i centri funzionali della molecola dell’emoglobina perché è qui che l’ossigeno si lega reversibilmente per formare ossiemoglobina.,
L’ossiemoglobina è un superoxo-ferriheme (Fe3+O2–) in cui vi è un trasferimento parziale temporaneo di un elettrone (carica negativa) dal ferro nell’eme all’ossigeno .
Quando l’ossigeno viene scaricato dall’ossiemoglobina nei tessuti, l’elettrone temporaneamente condiviso viene riconquistato dall’atomo di ferro, tornando al suo stato ferroso (Fe2+).
Qualunque sia il dettaglio preciso del legame dell’ossigeno all’emoglobina, è chiaro che per il legame, gli atomi di ferro presenti in ciascuno dei quattro gruppi eme devono essere nello stato ferroso.,
L’unica differenza tra emoglobina e metaemoglobina è che uno o più dei quattro atomi di ferro nella molecola di metaemoglobina sono nello stato ferrico (Fe3+) piuttosto che ferroso (Fe2+) e sono quindi incapaci di legare l’ossigeno .
La conversione del ferro dallo stato ferroso allo stato ferrico rappresenta la perdita di un elettrone, cioè è un processo ossidativo.,
La formazione di metaemoglobina dall’emoglobina all’interno dei globuli rossi è un processo ossidativo in corso che deriva dall’esposizione dell’emoglobina a una varietà di molecole altamente reattive (radicali liberi dell’ossigeno), prodotte durante il normale metabolismo cellulare .
L’effetto dell’ossidazione mediata dai radicali liberi non è limitato alla molecola dell’emoglobina; molte specie molecolari nelle cellule in tutto il corpo sono interessate. Se lasciato incontrollato, tali cambiamenti molecolari ossidativi possono influenzare la funzione e possono in ultima analisi causare distruzione cellulare e lesioni.,
Il globulo rosso e il suo contenuto (inclusa l’emoglobina) sono considerati particolarmente sensibili a questo stress ossidativo a causa della concentrazione di ossigeno relativamente elevata presente e della conseguente produzione di radicali liberi dell’ossigeno .
La metaemoglobina si forma anche durante lo scarico dell’ossigeno dalla deossiemoglobina nei tessuti se, come talvolta accade, l’elettrone temporaneamente donato per formare superoxo-ferriheme non viene ricatturato dall’atomo di ferro; questo processo è chiamato auto-ossidazione .,
È stato stimato che circa il 3% dell’emoglobina viene convertita in metaemoglobina ogni giorno da questi due meccanismi ossidativi.
Fortunatamente, in considerazione della potenziale minaccia alla somministrazione di ossigeno che la metaemoglobina pone, esistono meccanismi protettivi che assicurano che la maggior parte di questa metaemoglobina venga convertita in emoglobina, in modo che non più dell ‘ 1-2% dell’emoglobina totale sia normalmente presente come metaemoglobina.,
Meccanismi fisiologici per la conversione della metaemoglobina in emoglobina
Affinché la metaemoglobina (MHb) possa essere convertita in ferro di emoglobina nello stato ferrico (Fe3+) in uno o tutti i quattro gruppi eme, devono essere ridotti allo stato ferroso (Fe 2+); in altre parole devono ottenere un elettrone.
Di gran lunga il mezzo più significativo per effettuare questo guadagno di elettroni è un sistema di riduzione degli enzimi presente nei globuli rossi, noto come citocromo b5-metaemoglobina reduttasi dipendente dal NADH.,
In condizioni fisiologiche questo sistema rappresenta quasi il 99% della riduzione giornaliera della metaemoglobina all’emoglobina.
Il sistema comprende tre elementi: dinucleotide nicotinammide ridotto (NADH); la proteina contenente eme, citocromo b5; e l’enzima, citocromo b5 reduttasi. Il donatore di elettroni è NADH, un prodotto dell’ossidazione del glucosio (glicolisi).
Gli elettroni passano dal NADH al citocromo b5 e infine alla metaemoglobina; il trasferimento di elettroni è catalizzato dall’enzima citocromo b5 reduttasi (FIGURA 1).,
FIGURA 1: NADH-dipendente dal citocromo b5 – metHb reduttasi di sistema
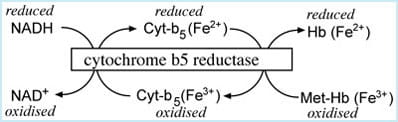
un’Altra riduzione di percorso, che dipende da un enzima NADPH-MHb reduttasi, è anche in grado di convertire methemoglobin di emoglobina, ma in condizioni fisiologiche normali, questo è di molto minore importanza.
Tuttavia, questa via alternativa è significativa nei casi di carenza di citocromo-b5-reduttasi ed essenziale per l’azione terapeutica del blu di metilene, il farmaco usato per trattare la metemoglobinemia acquisita.,
Infine diverse specie antiossidanti generali (cioè che donano elettroni) presenti nei globuli rossi, come il glutatione ridotto e l’acido ascorbico, possono svolgere un ruolo minore nel ridurre la metaemoglobina all’emoglobina.
CAUSE DI METAEMOGLOBINEMIA
La metaemoglobinemia è un aumento anormale della concentrazione di metaemoglobina, spesso espressa come una percentuale aumentata dell’emoglobina totale.
La metaemoglobinemia può essere ereditata o acquisita dopo l’esposizione a uno qualsiasi di una gamma di sostanze chimiche e farmaci ambientali ossidanti.,
Metaemoglobinemia ereditaria
Sono stati descritti diversi difetti ereditari rari nel gene che regola la produzione dell’enzima citocromo b5 reduttasi .
La conseguente carenza enzimatica congenita causa metaemoglobinemia perché la velocità con cui la metaemoglobina viene convertita in emoglobina non può tenere il passo con la velocità con cui si forma. Esistono due tipi principali; il più comune è il tipo I in cui il deficit enzimatico è limitato ai globuli rossi.,
Nel tipo II, l’enzima è carente non solo nei globuli rossi, ma in una gamma di altri tipi di cellule, compresi quelli del cervello . Questa forma più grave ma estremamente rara è associata a ritardo mentale e una serie di anomalie neurologiche che di solito portano alla morte durante gli anni dell’infanzia.
Diversi difetti ereditari della struttura dell’emoglobina, tutti designati Emoglobina M (HbM), provocano metaemoglobinemia., Sono caratterizzati da singole sostituzioni di amminoacidi nelle catene polipeptidiche alfa o beta nella regione in cui è attaccata la porzione eme contenente ferro.
Questi cambiamenti hanno l’effetto di rendere qualsiasi ferro nello stato ferrico ossidato più stabile e resistente all’effetto di ridurre i sistemi enzimatici rispetto all’emoglobina normale (HbA), in modo che la metaemoglobina non possa essere convertita in emoglobina in quelli con HbM.
Non è disponibile un trattamento per abbassare la metaemoglobina causata da HbM., Quelli con deficit enzimatico richiedono un trattamento permanente con un agente che ha lo stesso effetto riducente dell’enzima carente; una dose giornaliera di acido ascorbico (vitamina C) e/o riboflavina (vitamina B2) si adatta a questo disegno terapeutico.
Metaemoglobinemia acquisita
La metaemoglobinemia ereditata è rara; molto più comunemente la metaemoglobinemia viene acquisita a seguito dell’esposizione a sostanze chimiche ossidanti, tra cui una serie di farmaci prescritti e auto-prescritti (da banco) (TABELLA 1).,
La metaemoglobinemia acquisita si verifica quando il tasso di ossidazione dell’emoglobina a metaemoglobina – a seguito dell’esposizione ossidante – supera la velocità con cui la metaemoglobina può essere ridotta dalla NADH citocromo b5-MHb reduttasi.
TABELLA 1: Farmaci o tossine che possono causare metaemoglobinemia
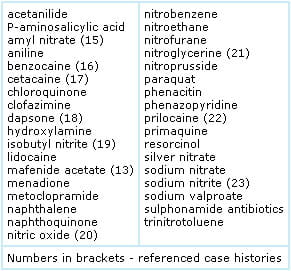
L’esposizione a sostanze ossidanti o farmaci può avvenire per ingestione, inalazione o assorbimento attraverso la pelle o le mucose. Alcuni farmaci o sostanze chimiche (ad es. nitriti) hanno un effetto ossidante diretto sull’emoglobina, mentre altri (ad es., dapsone) devono il loro potenziale ossidante ad un prodotto metabolico.
SEGNI E SINTOMI DI METAEMOGLOBINEMIA
L’ossidazione del ferro (dallo stato ferroso a quello ferrico) nella porzione eme dell’emoglobina impedisce il legame dell’ossigeno in quel sito, riducendo la capacità di carico dell’ossigeno. Inoltre, l’ossidazione del ferro in uno o più dei quattro siti eme della molecola di emoglobina aumenta l’affinità per l’ossigeno in tutti i restanti siti eme “normali”. Di conseguenza il rilascio di ossigeno a livello tissutale è ridotto.,
L’anemia funzionale che caratterizza la metaemoglobinemia è dovuta all’effetto combinato della ridotta capacità di carico dell’ossigeno e del ridotto rilascio di ossigeno ai tessuti.
L’estensione e la gravità dei sintomi sono direttamente proporzionali alla percentuale di emoglobina che è stata ossidata a metaemoglobina (disfunzionale). La metaemoglobinemia lieve (2-10%) è generalmente ben tollerata e, in un individuo altrimenti sano, è asintomatica.,
Il primo segno di ipossia tissutale, evidente quando la metaemoglobina supera il 10-15 %, è la cianosi con la pelle che assume un aspetto classico blu/grigio ardesia.
I sintomi di ipossia più profonda, tra cui aumento della frequenza cardiaca, mal di testa, vertigini e ansia, accompagnano l’approfondimento della cianosi poiché la metaemoglobina supera il 20 %. La metaemoglobinemia grave (>50 %) è associata ad un aumento della dispnea e dell’affaticamento.
Ne derivano confusione, sonnolenza e coma; ci possono essere convulsioni., L’analisi dei gas ematici rivela acidosi metabolica (lattica) conseguente al metabolismo cellulare anaerobico. La metaemoglobina > 70% è spesso fatale.
I sintomi per una data percentuale di metaemoglobina sono generalmente più gravi in un paziente che ha qualche condizione preesistente (ad esempio anemia, malattie respiratorie o cardiovascolari) che compromette l’ossigenazione dei tessuti.
TEST DI OSSIGENAZIONE UTILIZZATI NEL PAZIENTE CIANOTICO
La cianosi è un segno clinico quasi invariabile di metaemoglobinemia significativa, sebbene non sia specifico per la condizione.,
Poiché la cianosi è una prova oggettiva di ossigenazione tissutale inadeguata, di solito spingerebbe il personale medico curante a ordinare test di ossigenazione, inclusa l’analisi dei gas del sangue arterioso e il monitoraggio della pulsossimetria.
Per il paziente la cui cianosi è il risultato di metaemoglobinemia, gli indici di ossigenazione (pO2 e sO2) misurati durante l’analisi dei gas ematici, così come le letture di pulsossimetria possono rimanere notevolmente normali, nonostante la cianosi spesso profonda.,
La ragione di questi risultati apparentemente anomali, possibilmente controintuitivi, vale la pena evidenziare perché possono essere diagnosticamente utili.
La pressione parziale dell’ossigeno nel sangue (pO2) è un parametro misurato durante l’analisi dei gas nel sangue che riflette la piccola frazione di ossigeno totale che viene disciolta nel plasma sanguigno, non quella legata all’emoglobina.,
La diffusione dell’ossigeno dagli alveoli dei polmoni al plasma sanguigno è il principale determinante di pO2 e questo non è compromesso dalla metaemoglobinemia, così che nonostante quella che potrebbe essere una grave cianosi, pO2 rimane normale in quelli con metaemoglobinemia.
La dissociazione di pO2 e cianosi nella metaemoglobinemia è diagnosticamente utile. La somministrazione di ossigeno aumenta la pO2 ma non riesce a correggere la cianosi nei pazienti con metaemoglobina.,
Al contrario, la somministrazione di ossigeno a pazienti la cui cianosi è il risultato di malattie respiratorie o cardiache provoca anche un aumento di pO2, ma in questo caso l’aumento è associato alla risoluzione della cianosi.
La saturazione dell’ossigeno riflette l’ossigeno legato all’emoglobina. Poiché la metaemoglobina non può legare l’ossigeno, la metaemoglobinemia è associata a una ridotta saturazione di ossigeno.,
Il risultato di saturazione dell’ossigeno (sO2) prodotto dall’analisi dei gas del sangue è falsamente normale nei pazienti con metaemoglobinemia perché si basa su un calcolo che presuppone una normale curva di dissociazione dell’ossigeno e la quasi assenza di disemoglobine, nessuna delle quali ovviamente riguarda quelli con metaemoglobinemia.
La saturazione di ossigeno può anche essere misurata mediante pulsossimetria, un metodo spettrofotometrico non invasivo basato sull’assorbanza della luce a due lunghezze d’onda, 660 e 990 nm.,
Il calcolo richiesto per calcolare la saturazione di ossigeno da queste misurazioni di assorbanza presuppone che solo ossi e desossiemoglobina siano presenti nel sangue; non ci sono disemoglobine. La saturazione di ossigeno misurata mediante pulsossimetria è ridotta in quelli con metaemoglobinemia.
Tuttavia, la riduzione non è correlata alla gravità della metaemoglobinemia .
Poiché la metaemoglobina aumenta dal 2 al 30 %, la saturazione di ossigeno scende dal normale (intorno al 98 %) a circa l ‘ 85 %, ma non si osserva ulteriore calo della saturazione di ossigeno se la metaemoglobina supera il 30-35 %., In un contesto clinico ciò significa che la saturazione di ossigeno misurata mediante pulsossimetria dà un’impressione falsamente ottimistica dell’ossigenazione tissutale tra quelli con metaemoglobinemia da moderata a grave.
Per riassumere, la cianosi associata alla metaemoglobinemia differisce dalla cianosi a causa di altre cause sotto due aspetti: non è associata a una ridotta pO2 e non risponde all’ossigenoterapia. I risultati di saturazione di ossigeno ottenuti durante l’analisi del gas arterioso sono falsamente normali nella metaemoglobinemia e le letture di pulsossimetria possono essere fuorvianti.,
L’unico metodo affidabile per misurare la concentrazione di metaemoglobina e confermare una diagnosi di metaemoglobinemia è la CO-ossimetria. La maggior parte dei moderni analizzatori di gas nel sangue ha un CO-ossimetro incorporato, che consente di esaminare spettrofotometricamente il sangue arterioso a più lunghezze d’onda. Tutte le specie di emoglobina hanno spettri di assorbanza caratteristici.
La CO-ossimetria consente quindi sia l’identificazione che la quantificazione di tutte le specie di emoglobina, inclusa la metaemoglobina., La CO-ossimetria consente anche il calcolo della saturazione di ossigeno; questo è un metodo più affidabile per valutare la saturazione di ossigeno nei pazienti con metaemoglobina rispetto alla pulsossimetria o all’analisi dei gas del sangue.
ALCUNE CASE HISTORY ILLUSTRATIVE
Case history 1:
La metaemoglobinemia ereditata è di solito benigna
Il caso riguarda un maschio di 25 anni che era sufficientemente preoccupato per il colore grigio-blu della sua pelle del viso da consultare un medico. Non aveva altre lamentele importanti., All’interrogatorio ha dichiarato che la sua tolleranza all’esercizio era buona, ma occasionalmente ha sofferto di mal di testa, vertigini e mancanza di respiro. L’esame clinico ha rivelato un uomo ben nutrito e sviluppato senza segni neurologici o cardiovascolari anormali.
L’unica scoperta anomala è stata la cianosi di viso, labbra, orecchie, dita delle mani e dei piedi. È emerso che il colore anormale della pelle era stato presente fin dall’infanzia., La storia passata ha rivelato il ricovero in ospedale per lo studio della cianosi a 9 mesi di età, ma nessuna diagnosi è stata fatta in questo momento o durante diverse altre consultazioni cliniche negli anni successivi.
In assenza di qualsiasi evidenza clinica che l’apparente cianosi congenita fosse dovuta a malattie cardiache o polmonari, la metaemoglobinemia ereditaria è stata considerata e confermata con il ritrovamento di una metaemoglobina del 40% e l’assenza dell’enzima eritrocita citocromo b5 reduttasi (deficit di tipo I).,
Il paziente è stato trattato con successo con una dose giornaliera di agenti riducenti la metaemoglobina ad azione lenta, acido ascorbico e riboflavina. Al follow-up di 6 mesi la metaemoglobina era del 20%; la cianosi si era risolta.
Questa casistica dimostra che la forma più comune di metaemoglobinemia ereditaria, il deficit di citocromo b5 reduttasi di tipo 1, è una condizione benigna che può rimanere non diagnosticata per molti anni.
Nonostante la marcata metaemoglobinemia, l’effetto cosmetico della cianosi era l’unico problema significativo per questo paziente., Nelle parole di un esperto che discute l’effetto clinico del deficit ereditario del citocromo b5 reduttasi di tipo 1, “questi pazienti sono davvero più blu che malati” .
Case history 2:
Il sangue color cioccolato-marrone suggerisce la metaemoglobinemia
Il sangue contenente un’alta concentrazione di metaemoglobina è di colore marrone cioccolato piuttosto che il rosso scuro del sangue deossigenato (venoso) o il rosso vivo del sangue ossigenato (arterioso). Come esemplifica questa casistica, il colore del sangue è spesso un utile puntatore diagnostico.,
Un uomo di 21 anni, JL ha subito ustioni estese che coprono il 68% della superficie corporea a seguito di un’esplosione.
La rimozione chirurgica della pelle bruciata e l’innesto cutaneo erano necessari durante un prolungato periodo di ospedalizzazione in un’unità regionale di ustioni.
Le ferite sono state trattate con medicazioni in mafenide-acetato per prevenire l’infezione. Durante il periodo di recupero, JL ha sviluppato una febbre cronica inspiegabile, suggerendo una possibile endocardite (infezione del cuore) ed è stata programmata per una procedura diagnostica chiamata ecocardiografia transesofagea, che consente l’esame ecografico del cuore.,
La procedura prevede il passaggio di una sonda ad ultrasuoni lungo la gola all’esofago, e in preparazione per questo la gola di JL è stata spruzzata con la benzocaina anestetica locale. Entro 10 minuti dalla procedura le condizioni di JL si sono improvvisamente deteriorate. Il colore della pelle è diventato scuro, con cianosi intorno alla bocca. Divenne sempre più letargico.
Pulsossimetria indicato saturazione di ossigeno era 88 % (normale 96-99 %) e gli è stato dato ossigeno. Nonostante l’ossigenoterapia e la ventilazione polmonare manuale non vi è stato alcun miglioramento clinico o cambiamento nella saturazione di ossigeno.,
È stato sospettato un embolo polmonare e il sangue arterioso è stato prelevato per i gas ematici. Il campione di sangue era scuro, quasi marrone cioccolato e si presumeva che fosse stato prelevato sangue venoso piuttosto che arterioso, quindi è stato ottenuto un secondo campione. Questo, troppo, è stato allo stesso modo è buio, ma è stato analizzato; gas del sangue risultati sono stati:
| pH | 7.54 |
| pCO2 | 3.2 kPa |
| pO2 | 39.9 kPa |
| Bicarbonato | 23,6 mmol/L |
| saturazione di Ossigeno | 98.,2% |
Al momento non è chiaro quale fosse il problema, ma l’embolo polmonare è stato escluso da PO2 sollevato e dalla normale radiografia del torace. Il colore costantemente scuro del sangue arterioso ha suggerito una diagnosi di metaemoglobinemia, che è stata confermata con la scoperta che il livello di metaemoglobina era del 40 %.
Le medicazioni di mafenide-acetato del paziente sono state immediatamente rimosse e il blu di metilene (2 mg / kg IV) è stato somministrato, la metaemoglobina è scesa presto a 1.,2 %, e JL recuperato da questa crisi senza conseguenze a lungo termine.
Dopo un ulteriore 2 mesi in ospedale riabilitazione da ustioni JL è stato finalmente dimesso a casa.,
Questo caso la storia esemplifica molti aspetti acquisiti metaemoglobinemia, tra cui l’esposizione a farmaci ossidanti (in questo caso benzocaina e mafenide acetato); cianosi non risponde alla terapia con ossigeno; falsamente normale saturazione dell’ossigeno di analisi dei gas del sangue; discordanza tra la saturazione dell’ossigeno di questo metodo rispetto a quello ottenuto mediante pulsossimetria; e l’efficacia immediata del blu di metilene terapia.
In questo caso è stato il colore marrone cioccolato del sangue arterioso che per primo ha avvisato gli assistenti della possibilità che la metaemoglobinemia fosse il problema.,
Case history 3:
Neonati ad aumentato rischio di metaemoglobinemia
Non è chiaro il motivo per cui alcune persone sviluppano metaemoglobinemia sintomatica quando esposte a sostanze chimiche ossidanti e farmaci, mentre altri no. Nel caso dei neonati, tuttavia, ci sono chiare ragioni fisiologiche per la suscettibilità.
I neonati sono particolarmente a rischio di metaemoglobinemia per due motivi principali. Durante lo sviluppo fetale e per i primi 3-6 mesi di vita, i globuli rossi contengono emoglobina fetale (HbF) piuttosto che emoglobina adulta (HbA).,
L’HbF è più facilmente ossidato a metaemoglobina rispetto all’HbA. Inoltre, l’enzima red cell citocromo b5 reduttasi necessaria per convertire la metaemoglobina in emoglobina è carente durante questo periodo.
Questi due fattori erano probabilmente significativi nel caso di una bambina di 6 settimane che è stata portata, in uno stato molto povero, al pronto soccorso del suo ospedale locale dopo una storia di diarrea di 2 giorni .
All’esame il bambino mostrava segni di disidratazione e si notava il colore della pelle scura., Segni vitali inclusi: frequenza cardiaca 150; pressione sanguigna 75/40; respirazioni 58/min e superficiale; e temperatura rettale 37,8 °C. Risultati di laboratorio inclusi ematocrito del 25,4 %.
Grave acidosi metabolica (pH 7,12, bicarbonato 6 mmol / L e pCO2 3,2 kPa) ha suggerito una scarsa perfusione tissutale che si presume sia il risultato di sepsi e il bambino è stato ricoverato in terapia intensiva.
La combinazione di PO2 sollevato (28 kPa) in associazione con ridotta saturazione di ossigeno (91-94 %) mediante pulsossimetria e sangue arterioso scuro ha suggerito una possibile metaemoglobinemia.,
Ciò è stato confermato con una metaemoglobina del 28 %. Il blu di metilene è stato somministrato e nel giro di 30 minuti il colore della pelle del bambino è tornato alla normalità e le sue condizioni generali sono notevolmente migliorate. È stata dimessa a casa 6 giorni dopo l’ammissione.
Questo è stato un caso di metaemoglobinemia acquisita che si verifica senza esposizione a un ossidante esogeno e dimostra la vulnerabilità dei bambini malati con diarrea e acidosi alla metaemoglobinemia.,
Si pensa che i batteri che formano nitrati nell’intestino, o altre specie ossidanti endogene associate alla diarrea, possano essere la causa precipitante in questi bambini, che sono già predisposti alla metaemoglobinemia.
SOMMARIO
La metaemoglobina è una forma inutile di emoglobina, che si forma costantemente nei globuli rossi del sangue periferico. Tuttavia, a causa dell’effetto di un sistema di riduzione degli enzimi che converte la metaemoglobina in emoglobina funzionale, la concentrazione rimane bassa in salute.,
L’aumento della concentrazione di metaemoglobina, chiamata metaemoglobinemia, riduce l’ossigenazione delle cellule tissutali, causando cianosi. La metaemoglobinemia grave (metaemoglobina >70% dell’emoglobina totale) è potenzialmente fatale.
L’analisi del sangue mediante CO-ossimetria fornisce i mezzi di diagnosi e il blu di metilene somministrato per via endovenosa, la principale modalità di trattamento. La metaemoglobinemia può essere dovuta a difetti genetici ereditari, ma molto più comunemente si verifica a seguito dell’esposizione a farmaci ossidanti o sostanze chimiche ossidanti ambientali.