fisiologia NORMAL
a principal função da hemoglobina, o fornecimento de oxigénio dos pulmões para as células dos tecidos, depende da afinidade variável que a hemoglobina tem para o oxigénio.esta afinidade depende principalmente da pressão parcial local do oxigénio (pO2), mas o pH, a pressão parcial do dióxido de carbono (pCO2) e a concentração de fosfatos orgânicos também são significativos.,as condições locais nos pulmões (pO2 relativamente elevado, pCO2 baixo, etc.) estão associadas com elevada afinidade, de modo que a hemoglobina se liga rapidamente ao oxigénio aqui; o produto desta ligação é a oxihemoglobina.
Por contraste na microvasculatura dos tecidos, as condições locais (pO2 relativamente baixo, pCO2 elevado, etc) estão associadas com baixa afinidade da hemoglobina para o oxigénio e a oxihemoglobina facilmente dissociam-se, libertando oxigénio para as células dos tecidos.,a molécula de hemoglobina adulta (HbA) é composta por quatro cadeias polipeptídicas dobradas (duas alfa e duas beta), cada uma das quais tem um grupo de heme porfirina ligado . No centro de cada um dos quatro grupos heme está um átomo de ferro no estado ferroso (Fe2+).
estes quatro átomos de ferro são os centros funcionais da molécula de hemoglobina porque é aqui que o oxigênio se liga reversivelmente para formar oxihemoglobina., oxihemoglobina é um superoxo-ferriheme (Fe3+O2 -) no qual há transferência parcial temporária de um elétron (carga negativa) do ferro na heme para o oxigênio . quando o oxigênio é descarregado da oxihemoglobina nos tecidos, o elétron temporariamente compartilhado é recapturado pelo átomo de ferro, retornando ao seu estado ferroso (Fe2+).qualquer que seja o detalhe preciso do oxigênio ligando-se à hemoglobina, é claro que para a ligação ocorrer, os átomos de ferro presentes em cada um dos quatro grupos heme devem estar no estado ferroso.,
a única diferença entre hemoglobina e metemoglobina é que um ou mais dos quatro átomos de ferro na molécula de metemoglobina estão no estado férrico (Fe3+) ao invés do ferroso (Fe2+) e são, portanto, incapazes de ligar oxigênio .a conversão do ferro do ferro do ferro para o estado férrico representa a perda de um elétron, ou seja, é um processo oxidativo.,
a formação de meta-hemoglobina a partir da hemoglobina dentro dos glóbulos vermelhos é um processo oxidativo em curso que resulta da exposição da hemoglobina a uma variedade de moléculas altamente reativas (radicais livres de oxigénio), produzidas durante o metabolismo celular normal .
O efeito da oxidação mediada por radicais livres não está confinado à molécula de hemoglobina; muitas espécies moleculares em células por todo o corpo são afetadas. Se não for controlado, tais alterações moleculares oxidativas podem afetar a função e podem, em última análise, causar ruptura celular e lesão.,
a célula vermelha e o seu conteúdo (incluindo hemoglobina) são considerados particularmente susceptíveis a este stress oxidativo devido à concentração relativamente elevada de oxigénio presente e à produção resultante de radicais livres de oxigénio .
Methemoglobin também é formado durante a descarga de oxigênio a partir de deoxihemoglobina nos tecidos se, como às vezes acontece, temporariamente, doados elétron para formar superoxo-ferriheme não é recapturado pelo átomo de ferro; esse processo é chamado de auto-oxidação .,estima-se que cerca de 3% da hemoglobina é convertida em meta-hemoglobina diariamente por estes dois mecanismos oxidativos.felizmente, tendo em conta a potencial ameaça ao fornecimento de oxigénio que a meta-hemoglobina representa, existem mecanismos de protecção que asseguram que a maior parte desta meta-hemoglobina é convertida de volta à hemoglobina, de modo que não mais de 1-2% da hemoglobina total está normalmente presente como meta-hemoglobina.,
mecanismos Fisiológicos para a conversão de methemoglobin à hemoglobina
Para methemoglobin (MHb), a ser convertida para a hemoglobina ferro no férrico (Fe3+) estado ou em qualquer um dos quatro grupos heme, que deve ser reduzida para ferrosa (Fe 2+) estado; em outras palavras, eles devem ganhar um elétron.
de longe, a forma mais significativa de efetivar este ganho de elétrons é um sistema redutor de enzimas presente nos glóbulos vermelhos, conhecido como citocromo dependente de NADH b5-metemoglobina redutase., em condições fisiológicas, este sistema representa cerca de 99% da redução diária de meta-hemoglobina para a hemoglobina.
o sistema compreende três elementos: dinucleótido reduzido de nicotinamida (NADH); proteína contendo heme, citocromo b5; e a enzima citocromo b5 redutase. O doador de elétrons é NADH, um produto da oxidação da glicose (glicólise).
os electrões passam de NADH para o citocromo b5 e finalmente para a meta-hemoglobina; a transferência electrónica é catalisada pela enzima citocromo b5 redutase (Figura 1).,
FIGURA 1: NADH-dependente do citocromo b5 – metHb redutase do sistema
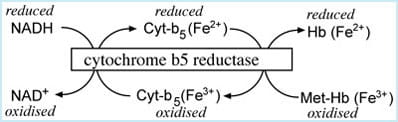
Outro redução caminho, que depende da enzima NADPH-MHb redutase, também é capaz de converter methemoglobin à hemoglobina, mas sob condições fisiológicas normais, este é de muito menor importância.no entanto, esta via alternativa é significativa em casos de deficiência de citocromo-b5-redutase e essencial para a acção terapêutica do azul de metileno, o fármaco utilizado no tratamento da metemoglobinemia adquirida.,finalmente, várias espécies antioxidantes gerais (ou seja, doadoras de electrões) presentes nos glóbulos vermelhos, tais como a redução da glutationa e do ácido ascórbico, podem desempenhar um papel menor na redução da meta-hemoglobina para a hemoglobina.
causas de metemoglobinemia
metemoglobinemia é um aumento anormal na concentração de metemoglobina, muitas vezes expresso como uma percentagem aumentada de hemoglobina total.
metemoglobinemia pode ser herdada ou adquirida após a exposição a qualquer uma de uma gama de produtos químicos oxidantes e drogas ambientais.,foram descritos vários defeitos hereditários raros no gene que regula a produção da enzima citocromo b5 redutase .
a deficiência enzimática congênita resultante causa metemoglobinemia porque a taxa a que metemoglobina é convertida em hemoglobina não pode manter o ritmo com a taxa a que é formada. Existem dois tipos principais; o mais comum é o tipo I no qual a deficiência enzimática está confinada aos glóbulos vermelhos.,
no tipo II, a enzima é deficiente não apenas nos glóbulos vermelhos, mas numa gama de outros tipos de células, incluindo as do cérebro . Esta forma mais grave, mas extremamente rara, está associada com atraso mental e uma série de anormalidades neurológicas que geralmente resultam em morte durante os anos de infância.
vários defeitos hereditários da estrutura da hemoglobina, toda a hemoglobina m (HbM) designada, resultam em metemoglobinemia., Eles são caracterizados por substituições únicas de aminoácidos nas cadeias alfa ou beta polipeptídicas na região onde a porção heme contendo ferro está ligada.
estas alterações têm o efeito de tornar qualquer ferro no estado férrico oxidado mais estável e resistente ao efeito dos sistemas enzimáticos redutores do que a hemoglobina normal (HbA), de modo que a meta-hemoglobina não pode ser convertida para hemoglobina em aqueles com HbM.não existe tratamento disponível para reduzir a meta-hemoglobina causada pela HbM., Aqueles com deficiência enzimática requerem tratamento ao longo da vida com um agente que tem o mesmo efeito de redução que a enzima deficiente; uma dose diária de ácido ascórbico (vitamina C) e/ou riboflavina (vitamina B2) encaixa neste perfil terapêutico.
metemoglobinemia adquirida
metemoglobinemia hereditária é rara; muito mais comumente metemoglobinemia é adquirida como resultado da exposição a produtos químicos oxidantes, incluindo uma gama de medicamentos prescritos e auto-prescritos (over-the-counter) (quadro 1).,
metemoglobinemia adquirida ocorre quando a taxa de oxidação da hemoglobina para a meta – hemoglobina – como resultado da exposição oxidante-excede a taxa a que a meta-hemoglobina pode ser reduzida pelo citocromo NADH b5-MHb redutase.
TABELA 1: Drogas ou toxinas que podem causar glacial
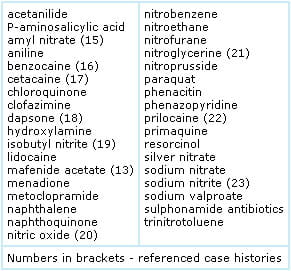
Oxidante-químicas ou drogas, a exposição pode ocorrer por ingestão, inalação ou absorção através da pele ou membranas mucosas. Algumas drogas ou produtos químicos (por exemplo, nitritos) têm um efeito oxidante direto na hemoglobina, enquanto outras (por exemplo, nitritos) têm um efeito oxidante direto na hemoglobina., dapsona) DEVEM o seu potencial oxidante a um produto metabólico.
sinais e sintomas de metemoglobinemia
oxidação do ferro (do ferro para o estado férrico) na porção heme da hemoglobina impede a ligação do oxigénio nesse local, reduzindo a capacidade de transporte de oxigénio. Além disso, a oxidação do ferro em um ou mais dos quatro locais heme da molécula de hemoglobina aumenta a afinidade para o oxigênio em todos os locais heme “normais” restantes . Consequentemente, a libertação de oxigénio ao nível dos tecidos é reduzida.,
a anemia funcional que caracteriza a metemoglobinemia é devido ao efeito combinado da redução da capacidade de transporte de oxigênio e redução da libertação de oxigênio para os tecidos.a extensão e gravidade dos sintomas são diretamente proporcionais à percentagem de hemoglobina que foi oxidada a meta-hemoglobina (disfuncional). Metemoglobinemia ligeira (2-10 %) é geralmente bem tolerada e, em um indivíduo saudável de outra forma, é assintomática.,
o primeiro sinal de hipoxia tecidular, evidente à medida que a meta-hemoglobina sobe acima de 10-15 %, é a cianose, com a pele a assumir um aspecto classicamente Azul/ardósia cinzenta. os sintomas de hipoxia mais profunda, incluindo aumento da frequência cardíaca, dores de cabeça, tonturas e ansiedade, acompanham o aprofundamento da cianose à medida que a meta-hemoglobina aumenta acima de 20 %. A metemoglobinemia grave (>50 %) está associada a aumento da falta de ar e fadiga.pode ocorrer confusão, sonolência e coma; podem ocorrer crises convulsivas., A análise dos gases sanguíneos revela acidose metabólica (láctica) consequente no metabolismo celular anaeróbico. Metemoglobina
70% é frequentemente fatal.os sintomas para uma dada percentagem de meta-hemoglobina são geralmente mais graves num doente com alguma condição pré-existente (por exemplo, anemia, doença respiratória ou cardiovascular) que compromete a oxigenação dos tecidos.
os testes de oxigenação utilizados no doente cianótico
cianose é um sinal clínico quase invariável de metemoglobinemia significativa, embora não seja específico para a condição.,uma vez que a cianose é evidência objetiva de oxigenação inadequada dos tecidos, ela normalmente levaria o pessoal médico que atendia a pedir testes de oxigenação, incluindo análise de gases sanguíneos arteriais e monitorização da oximetria de pulso.
para o paciente cuja cianose é o resultado de metemoglobinemia, índices de oxigenação (pO2 e sO2) medidos durante a análise dos gases sanguíneos, bem como leituras de oximetria de pulso podem permanecer notavelmente normais, apesar de muitas vezes cianose profunda.,
A razão para estes resultados aparentemente anômalos, possivelmente contra-intuitivos vale a pena destacar porque eles podem ser úteis em diagnóstico.
pressão parcial de oxigénio no sangue (pO2) é um parâmetro medido durante a análise dos gases sanguíneos que reflecte a pequena fracção de oxigénio total dissolvido no plasma sanguíneo, não que se liga à hemoglobina.,
difusão de oxigênio dos alvéolos dos pulmões para o plasma sanguíneo é o principal determinante de pO2 e isso não é prejudicado pela metemoglobinemia, de modo que, apesar do que pode ser cianose grave, pO2 permanece normal em aqueles com metemoglobinemia.
a dissociação de pO2 e cianose na metemoglobinemia é útil em diagnóstico. A administração de oxigênio aumenta a pO2, mas não corrige a cianose em pacientes com metemoglobina.,
Por outro lado, a administração de oxigénio a doentes cuja cianose é o resultado de doenças respiratórias ou cardíacas também causa um aumento no pO2, mas neste caso o aumento está associado à resolução da cianose.
saturação de oxigénio reflecte a ligação de oxigénio à hemoglobina. Uma vez que a meta-hemoglobina não se liga ao oxigénio, a metemoglobinemia está associada a uma redução da saturação de oxigénio.,
A saturação de oxigênio (sO2) resultado produzido por gasometria é falsamente normal em pacientes com glacial, porque é baseada em um cálculo que considera normal a curva de dissociação do oxigênio e a quase ausência de dyshemoglobins, nem de que, naturalmente, relacionados com glacial.
saturação de oxigénio também pode ser medida por oximetria de pulso, um método espectrofotométrico não invasivo que é baseado na absorvância da luz em dois comprimentos de onda, 660 e 990 nm.,
The computation required to calculate oxygen saturation from these absorbance measurements assumes that only oxy-and deoxyhemoglobina are present in blood; there are no dyshemoglobins. A saturação de oxigênio medida pela oximetria de pulso é reduzida em aqueles com metemoglobinemia.no entanto, a redução não está correlacionada com a gravidade da metemoglobinemia .
à medida que a meta-hemoglobina aumenta de 2 para 30 %, a saturação de oxigénio desce do normal (cerca de 98 %) para cerca de 85 %, mas não se observa mais nenhuma queda na saturação de oxigénio se a meta-hemoglobina aumentar para além de 30-35 %., Em um cenário clínico isso significa que a saturação de oxigênio medida pela oximetria de pulso dá uma impressão falsamente otimista de oxigenação de tecidos entre aqueles com metemoglobinemia moderada a grave.
para resumir, a cianose associada à metemoglobinemia difere da cianose devido a outras causas em dois aspectos: não está associada a pO2 reduzida e não responde à terapêutica com oxigénio. Os resultados de saturação de oxigênio obtidos durante a análise de gás arterial são falsamente normais em metemoglobinemia, e leituras de oximetria de pulso podem ser enganosas.,
O único método fiável para medir a concentração de metemoglobina e confirmar um diagnóstico de metemoglobinemia é a CO-oximetria. A maioria dos analisadores de gases sanguíneos modernos têm um co-oxímetro incorporado, que permite que o sangue arterial seja espectrofotometricamente examinado em vários comprimentos de onda. Todas as espécies de hemoglobina têm espectros característicos de absorvância. a co-oximetria permite a identificação e quantificação de todas as espécies de hemoglobina, incluindo a metemoglobina., CO-oximetria também permite o cálculo da saturação de oxigênio; este é um método mais confiável de avaliar a saturação de oxigênio em pacientes com meta-hemoglobina do que a oximetria de pulso ou análise de gases sanguíneos.
ALGUNS ILUSTRATIVOS HISTÓRIAS de CASO
o histórico do Caso 1:
Herdadas glacial é geralmente benigno
O caso refere-se a 25 anos, sexo masculino, que estava bastante preocupado com o cinzento-azul da cor de sua pele facial para procurar um médico. Ele não tinha outras queixas., Ao questioná-lo, ele afirmou que sua tolerância ao exercício era boa, mas ocasionalmente ele sofria de dores de cabeça, vertigens e falta de ar. O exame clínico revelou um homem bem nutrido e desenvolvido sem sinais neurológicos ou cardiovasculares anormais. o único resultado anormal foi cianose da face, lábios, orelhas, dedos das mãos e dos pés. Revelou-se que a cor anormal da pele estava presente desde a infância., A história anterior revelou hospitalização para investigação de cianose aos 9 meses de idade, mas nenhum diagnóstico foi feito neste momento ou durante várias outras consultas clínicas ao longo dos anos seguintes.
Na ausência de qualquer evidência clínica de que a aparente congênita cianose foi devido ao cardíaca ou doença pulmonar, herdada glacial foi considerado e confirmada com a descoberta de um methemoglobin de 40% e a ausência do vermelho-célula enzima citocromo b5 redutase (Tipo eu deficiência)., o doente foi tratado com sucesso com uma dose diária de agentes redutores da meta-hemoglobina de acção lenta, ácido ascórbico e riboflavina. No seguimento de 6 meses da meta-hemoglobina foi de 20 %; a cianose tinha desaparecido.
Neste caso, a história demonstra que a forma mais comum de herdou glacial, tipo 1 da citocromo b5 redutase deficiência, é uma condição benigna que pode permanecer sem diagnóstico por muitos anos.apesar da metemoglobinemia marcada, o efeito cosmético da cianose foi o único problema significativo para este doente., Nas palavras de um especialista discutindo o efeito clínico da deficiência herdada do citocromo b5 redutase tipo 1, “estes pacientes são realmente mais azuis do que doentes” .
o histórico do Caso 2:
Chocolate-marrom cor-de-sangue sugere glacial
Sangue que contém uma alta concentração de methemoglobin é castanho chocolate na cor, ao invés do que o vermelho escuro do sangue desoxigenado (venoso) ou o vermelho brilhante do oxigenado (arterial) de sangue. Como este caso histórico exemplifica, a cor do sangue é muitas vezes um indicador de diagnóstico útil.,um homem de 21 anos, JL sofreu queimaduras extensas cobrindo 68% da superfície do corpo após uma explosão.durante um período prolongado de hospitalização numa Unidade regional de queimaduras, foi necessária a remoção cirúrgica da pele queimada e a enxertia cutânea.as feridas foram tratadas com pensos de acetato de mafenida para prevenir infecções. Durante o período de recuperação, a LJ desenvolveu febre crónica inexplicável, sugerindo possível endocardite (infecção do coração) e foi programada para um procedimento de diagnóstico chamado ecocardiografia transesofágica, que permite o exame de ultra-som do coração., o procedimento envolve passar uma sonda ultrassom pela garganta até o esôfago, e em preparação para a garganta deste JL foi pulverizada com o anestésico local benzocaína. Dez minutos depois do procedimento, a condição da JL deteriorou-se subitamente. A cor da pele tornou-se escura, com cianose à volta da boca. Tornou-se cada vez mais letárgico.
oximetria de pulso indicou saturação de oxigênio em 88% (normal 96-99%) e ele recebeu oxigênio. Apesar da terapêutica com oxigénio e da ventilação manual do pulmão não houve melhoria clínica ou alteração na saturação de oxigénio.,suspeita-se de embolia pulmonar e foi colhido sangue arterial para análise de gases sanguíneos. A amostra de sangue era escura, quase castanha de chocolate e foi assumido que o sangue venoso em vez de arterial tinha sido amostrado, então uma segunda amostra foi obtida. Este, também, foi igualmente escuro, mas foi analisado; gases sanguíneos resultados foram:
| pH | 7.54 |
| pCO2 | 3.2 kPa |
| pO2 | 39.9 kPa |
| Bicarbonato | 23.6 mmol/L |
| saturação de Oxigênio | 98.,2 % |
permaneceu incerto nesta altura qual era o problema, mas a embolia pulmonar foi excluída pela PO2 elevada e radiografia torácica normal. A cor consistentemente escura do sangue arterial sugeriu um diagnóstico de metemoglobinemia, que foi confirmado com a descoberta de que o nível de meta-hemoglobina era de 40 %.os pensos de acetato de mafenida do doente foram imediatamente removidos e o azul de metileno (2 mg/kg IV) foi administrado e a meta-hemoglobina logo caiu para 1.,2 % e a JL recuperou desta crise sem quaisquer consequências a longo prazo.depois de mais 2 meses em reabilitação hospitalar de queimaduras, JL acabou sendo dispensado de casa.,
Esta história de caso exemplifica vários aspectos de adquiridos glacial, incluindo a exposição a oxidantes drogas (neste caso, benzocaine e acetato de mafenide); cianose de responder à terapia de oxigênio; falsamente normal saturação de oxigênio pelo sangue de análise de gás; discordância entre a saturação de oxigênio por este método em comparação com o obtido pela oximetria de pulso; e a imediata eficácia de azul de metileno a terapia.neste caso, foi a cor castanho-chocolate do sangue arterial que alertou os cuidadores para a possibilidade de que a metemoglobinemia era o problema.,
Case history 3:
Newborns at increased risk of methemoglobinemia
It remains unclear why some people develop sintomatic methemoglobinemia when exposed to oxidant chemicals and drugs, while others do not. No caso dos recém-nascidos, no entanto, existem razões fisiológicas claras para a susceptibilidade.os recém-nascidos correm um risco particular de metemoglobinemia por duas razões principais. Durante o desenvolvimento fetal e nos primeiros 3-6 meses de vida, os glóbulos vermelhos contêm hemoglobina fetal (HbF) ao invés de hemoglobina adulta (HbA).,
HbF é mais rapidamente oxidado a meta-hemoglobina do que HbA. Além disso, a enzima citocromo b5 redutase dos glóbulos vermelhos necessária para converter a meta-hemoglobina em hemoglobina é deficiente durante este período.estes dois fatores foram provavelmente significativos no caso de uma menina de 6 semanas que foi levada, em um estado muito pobre, para as urgências de seu hospital local após um histórico de 2 dias de diarréia .durante o exame, o bebé mostrou sinais de desidratação e observou-se uma cor de pele escura., Os sinais vitais incluíam: frequência cardíaca 150; pressão arterial 75/40; respiração 58/min e pouco profunda; e temperatura rectal 37,8 °C. os resultados laboratoriais incluíram hematócrito de 25,4 %.
acidose metabólica grave (pH 7, 12, bicarbonato de 6 mmol / L e pCO2 3, 2 kPa) sugeriu uma perfusão tecidular fraca que se presume ser o resultado de sépsis e o bebé foi admitido nos cuidados intensivos.
A combinação de pO2 aumentado (28 kPa) em associação com redução da saturação de oxigênio (91-94%) por oximetria de pulso, e sangue arterial escuro sugeriu possível metemoglobinemia.,isto foi confirmado com uma meta-hemoglobina de 28 %. O azul de metileno foi administrado, e em 30 minutos a cor da pele do bebê voltou ao normal e sua condição geral melhorou dramaticamente. Ela teve alta em casa seis dias após a admissão.este foi um caso de metemoglobinemia adquirida ocorrendo sem exposição a um oxidante exógeno, e demonstra a vulnerabilidade de bebês doentes com diarreia e acidose a metemoglobinemia.,pensa-se que as bactérias que formam nitratos no intestino, ou outras espécies oxidantes endógenas associadas à diarreia, podem ser a causa precipitante nestes bebés, que já estão predispostos a metemoglobinemia.
resumo
metemoglobina é uma forma inútil de hemoglobina, que está constantemente a ser formada nos glóbulos vermelhos do sangue periférico. No entanto, devido ao efeito de um sistema de redução de enzimas que converte a meta-hemoglobina em hemoglobina funcional, a concentração permanece baixa na saúde.,o aumento da concentração de metemoglobina, denominada metemoglobinemia, reduz a oxigenação das células dos tecidos, causando cianose. Metemoglobinemia grave (meta-hemoglobina
a análise do sangue por CO-oximetria fornece os meios de diagnóstico e azul de metileno administrado intravenosamente, o principal modo de tratamento. Metemoglobinemia pode ser devido a defeitos genéticos hereditários, mas muito mais comumente surge como resultado da exposição a drogas oxidantes ou produtos químicos oxidantes ambientais.