Q1. Que sait la FDA sur le lymphome associé aux implants mammaires?
A1. La FDA a d’abord identifié une association possible entre les implants mammaires et le développement D’ALCL en 2011. À cette époque, la FDA connaissait si peu de cas de cette maladie qu’il n’était pas possible de déterminer quels facteurs augmentaient le risque., Dans un rapport résumant les conclusions de l’agence, nous avons souligné la nécessité de recueillir des renseignements supplémentaires pour mieux caractériser L’ALCL chez les personnes porteuses d’implants mammaires. En 2016, L’Organisation Mondiale de la santé a désigné le lymphome anaplasique à grandes cellules associé aux implants mammaires (BIA-ALCL) comme un lymphome à cellules T pouvant se développer à la suite d’implants mammaires et a noté que le nombre exact de cas restait difficile à déterminer en raison de limitations importantes dans les rapports mondiaux et du manque de données,
Depuis lors, la FDA a pris plusieurs mesures pour mieux comprendre cette question, y compris un examen approfondi des données des études post-approbation, des rapports sur les dispositifs médicaux, de la littérature scientifique et des registres spécifiques aux implants mammaires, et des discussions publiques. Nous avons régulièrement communiqué sur les risques associés aux implants mammaires et entendu des patientes qui sont préoccupées par le fait que leurs implants soient liés à divers problèmes de santé. En mars 2019, nous avons discuté de nombreuses préoccupations importantes concernant les implants mammaires lors d’une réunion du Comité consultatif public.
T2. QU’est-ce que BIA-ALCL?, BIA-ALCL est-il un cancer du sein?
A2. Le lymphome associé aux implants mammaires (BIA – ALCL) n’est pas un cancer du sein-c’est un type de lymphome non hodgkinien (cancer du système immunitaire). Dans la plupart des cas, le BIA-ALCL se trouve dans le tissu cicatriciel et le liquide près de l’implant, mais dans certains cas, il peut se propager dans tout le corps. Le risque de développer une LFI-ALCL est considéré comme faible; cependant, ce cancer est grave et peut entraîner la mort, surtout s’il n’est pas traité rapidement., Chez la plupart des patients, il est traité avec succès par une intervention chirurgicale pour retirer l’implant et le tissu cicatriciel environnant, et chez certains patients, également un traitement par chimiothérapie et radiothérapie.
T3. Quels sont les symptômes de BIA-ALCL?
A3. Les principaux symptômes de BIA-ALCL sont un gonflement persistant, la présence d’une masse ou une douleur dans la région de l’implant mammaire. Ces symptômes peuvent survenir bien après la guérison de l’incision chirurgicale, souvent des années après la pose de l’implant.
lors de l’évaluation par un fournisseur de soins de santé, des signes de collecte de liquide autour de l’implant mammaire (sérome) sont souvent observés., Certains rapports de patients ont indiqué qu’une bosse sous la peau ou une contracture capsulaire (capsule cicatricielle épaisse et visible autour de l’implant) étaient présents.
T4. Où dans le sein a-t-on trouvé BIA-ALCL?
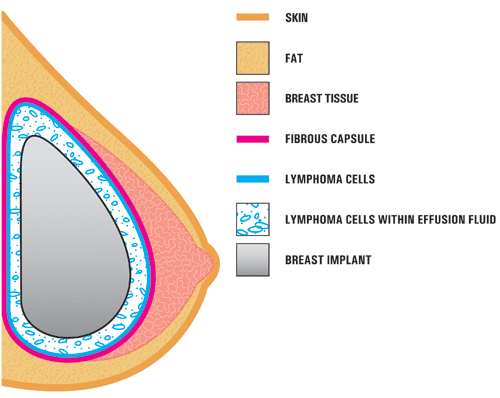
A4. Dans les études de cas rapportées dans la littérature, BIA-ALCL se trouve généralement près de l’implant mammaire, contenu dans la capsule cicatricielle fibreuse, et non dans le tissu mammaire lui-même. L’illustration ci-dessous montre l’emplacement de L’ALCL dans ces rapports. Dans la plupart des cas, les cellules ALCL ont été trouvées dans le liquide entourant l’implant (sérome) ou contenues dans la capsule cicatricielle fibreuse.,
Q5. La texture de surface de la coque de l’implant mammaire–lisse par rapport à texturée–augmente-t-elle le risque de développer une BIA-ALCL?
A5. Nous avons évalué le nombre croissant de preuves, y compris de nouveaux rapports sur les dispositifs médicaux provenant des États-Unis et du monde entier sur le nombre total de cas de LFI-ALCL. Ceux-ci incluent des décès supplémentaires récemment signalés à la FDA et dans la littérature scientifique., En conséquence, nous avons déterminé que:
- toutes les patientes qui ont des implants mammaires ou qui envisagent de les obtenir doivent être conscientes du risque de BIA-ALCL.
- le risque de BIA-ALCL est plus élevé pour les implants à surface texturée que pour les implants à surface lisse.
- certains autres produits mammaires texturés, en particulier certains Extenseurs tissulaires texturés, ne devraient pas être utilisés, et nous avons émis de nouvelles recommandations pour les patientes qui ont ou ont eu ces produits.
Q6. Certains Extenseurs de tissus texturés pourraient-ils augmenter le risque de BIA-ALCL?
A6., La FDA estime que les extenseurs de tissu avec une certaine surface texturée peuvent être préoccupants. Ces Extenseurs tissulaires ne devraient pas être utilisés et nous avons émis de nouvelles recommandations pour les patients qui ont ou ont eu ces produits. Les extenseurs tissulaires sont indiqués pour être utilisés pendant seulement 6 mois, et à ce jour, il existe peu d’informations sur l’association éventuelle d’une exposition temporaire au risque de LFI-ALCL. D’autres Extenseurs de tissu qui n’utilisent pas la surface texturée préoccupante sont facilement disponibles aux États-Unis., Un extenseur tissulaire est utilisé pour étirer la peau et d’autres tissus avant la reconstruction mammaire après mastectomie, la correction d’un sein sous-développé, la révision cicatricielle et les procédures de défaut tissulaire. Il s’agit d’un implant temporaire, placé sous la peau du sein ou les muscles de la poitrine pour étirer la peau et d’autres tissus, et est destiné à être remplacé par un implant mammaire à une date ultérieure.
Q7. Le remplissage de l’implant mammaire–silicone versus solution saline–augmente-t-il le risque de développer un BIA-ALCL?
A7., Selon les données actuellement disponibles, le type de remplissage d’implant ne semble pas être un facteur de risque de LFI-ALCL, mais cela n’a pas été évalué dans une vaste étude épidémiologique bien conçue. À ce jour, il n’y a pas eu suffisamment de données pour déterminer si ALCL peut être trouvé plus ou moins fréquemment chez les personnes avec des implants mammaires remplis de silicone par rapport aux personnes avec des implants mammaires remplis de solution saline.
Q8. Que devraient faire les professionnels de la santé et les patients?
A8.La FDA recommande que les fournisseurs de soins de santé continuent de fournir à leurs patients des soins et un soutien de routine.,
professionnels de la santé:
- Vous devez immédiatement cesser d’utiliser (implanter) les implants mammaires et les extenseurs tissulaires énumérés dans la communication de sécurité de la FDA du 24 juillet 2019; et travailler avec votre établissement pour retourner l’inventaire existant.
- nous ne recommandons pas le retrait systématique de ces types ou d’autres d’implants mammaires chez les patientes qui ne présentent aucun symptôme.,
- Vous devez informer vos patients qui ont les implants et les extenseurs tissulaires énumérés dans la communication de sécurité de la FDA du 24 juillet 2019 des risques de conséquences néfastes graves pour la santé, y compris le potentiel de développement de BIA-ALCL.
- avant l’implantation d’un implant mammaire, fournissez à vos patientes l’étiquetage du fabricant, ainsi que tout autre matériel éducatif, et discutez des avantages et des risques des différents types d’implants.
- envisager la possibilité de BIA-ALCL lors du traitement d’un patient présentant des modifications péri-implantaires tardives., Dans certains cas, les patients ont présenté un sérome, une masse, un durcissement adjacent à l’implant mammaire. Si vous avez un patient suspecté de BIA-ALCL, référez le cas du patient à des experts familiers avec le diagnostic et le traitement de BIA-ALCL.
- recueillir du liquide de sérome frais et des parties représentatives de la capsule et envoyer des tests de pathologie pour exclure BIA-ALCL., L’évaluation diagnostique devrait inclure l’évaluation cytologique du liquide ou de la masse du sérome avec des frottis colorés de Wright Giemsa et des tests d’immunohistochimie par blocs cellulaires/cytométrie en flux pour les marqueurs de différenciation en grappe (CD30) et de lymphome kinase anaplasique (ALK).
- développer un plan de traitement individualisé en coordination avec des experts familiers avec le diagnostic et le traitement de BIA-ALCL. Tenez compte des lignes directrices de pratique clinique actuelles, telles que celles de la Plastic Surgery Foundation ou du National Comprehensive Cancer Network (NCCN) lors du choix de votre approche thérapeutique.,
Patients:
- Si vous n’avez aucun symptôme, nous ne recommandons pas le retrait des implants et des extenseurs tissulaires énumérés dans la communication de sécurité de la FDA du 24 juillet 2019; ou d’autres types d’implants mammaires en raison de préoccupations liées au risque de développer BIA-ALCL.
- connaissez les symptômes de BIA-ALCL, principalement un gonflement persistant, la présence d’une masse ou une douleur à proximité de l’implant mammaire et surveillez la zone autour de vos implants mammaires pour tout changement.,
- Si vous ressentez l’un de ces symptômes ou d’autres changements, parlez à votre fournisseur de soins de santé de la nécessité d’une évaluation plus approfondie. L’évaluation de BIA-ALCL implique généralement un examen physique, une imagerie et/ou une évaluation du liquide ou du tissu autour de l’implant mammaire. Il est important de subir une évaluation pour diagnostiquer le BIA-ALCL, car un diagnostic confirmé de BIA-ALCL peut modifier le type d’opération à effectuer.,
- Les Patients avec une LBI-ALCL confirmée doivent subir le retrait de l’implant avec le retrait de la capsule cicatricielle environnante, ce qui est une opération plus étendue que le retrait de l’implant seul.
- comme pour tout dispositif implanté, il est bon de conserver un enregistrement du fabricant du dispositif et du nom du modèle d’implant. Vous avez peut-être reçu cette information sur une carte de dispositif patient de votre chirurgien. Si vous souhaitez obtenir le nom du fabricant et le modèle de vos implants, pensez à demander à votre chirurgien ou à obtenir le dossier de votre chirurgie (notes opératoires) de l’établissement où elle a été pratiquée.,
- comprenez que la plupart des cas de BIA-ALCL surviennent des années après la pose de l’implant mammaire et présentent des symptômes ou des changements autour de l’implant mammaire. Parlez à votre chirurgien de votre risque de développer BIA-ALCL.
- Si vous envisagez d’implants mammaires, veuillez consulter ces recommandations importantes.
Nous continuerons de rendre compte des résultats importants à mesure que de nouvelles informations et analyses seront disponibles.
Q9. Comment les professionnels de la santé peuvent-ils signaler les cas de LFI-ALCL chez leurs patients?
A9., Les professionnels de la santé doivent:
- signaler tous les cas de BIA-ALCL chez les personnes porteuses d’implants mammaires à MedWatch, le programme D’information sur l’innocuité et de signalement des effets indésirables de la FDA.
- Le personnel de soins de santé employé par les établissements assujettis aux exigences de la FDA en matière de déclaration des établissements utilisateurs devrait suivre les procédures de déclaration établies par leurs établissements. La notification rapide des effets indésirables peut aider la FDA à identifier et à mieux comprendre les risques associés aux dispositifs médicaux. Dans certains cas, la FDA peut vous contacter pour obtenir des informations supplémentaires., La FDA gardera confidentielles les identités du personnel signalant l’événement et du patient.
- soumettre les rapports de cas de BIA-ALCL au Registre des patientes et les résultats pour les Implants mammaires et le Registre d’étiologie et D’épidémiologie du lymphome anaplasique à grandes cellules (profil) afin de contribuer à une meilleure compréhension des causes et des traitements de BIA-ALCL.
Q10. Si une personne envisage des implants mammaires, que devraient-ils faire?
A10. Il y a plusieurs choses importantes à considérer avant de décider de subir une chirurgie mammaire., Cette liste est disponible auprès de la FDA À (choses révisées à considérer avant D’obtenir des Implants mammaires dans les risques et les Complications) pour vous aider à être pleinement informé si vous envisagez une augmentation mammaire, une reconstruction avec un implant ou une révision (remplacement) d’un implant que vous avez déjà. Plus important encore, vous et votre chirurgien devriez discuter de vos objectifs et attentes concernant les implants mammaires, les avantages et les risques, la nécessité de surveiller votre implant pour les complications aussi longtemps que vous les avez, et le retrait ou le remplacement éventuel.
Q11. Quelles mesures la FDA continuera-t-elle de prendre?,
A11. La FDA continue de collecter et d’évaluer des informations sur le BIA-ALCL chez les personnes porteuses d’implants mammaires et qui ont utilisé des extenseurs tissulaires.
de façon continue, nous:
- recevons et examinons les rapports sur les instruments médicaux (DDM).
- passez en revue la littérature médicale actuelle.
- échanger des informations avec d’autres régulateurs et experts scientifiques américains et internationaux.,
- examiner les données du Registre des patients et les résultats pour les Implants mammaires et le lymphome anaplasique à grandes cellules (ALCL) étiologie et épidémiologie (registre de profil) (un effort de collaboration avec L’American Society of Plastic Surgeons (ASPS) et la Plastic Surgery Foundation (PSF)).
- passez en revue les informations que les fabricants d’implants mammaires incluent À propos de BIA-ALCL dans leur étiquetage des patients et des professionnels de la santé.
- examiner l’information fournie par les études post-commercialisation en cours.
- surveiller les effets indésirables à partir d’autres données réelles (p. ex. Registre national des implants mammaires).,
Q12. Quelles mesures ont été prises par les sociétés professionnelles et les organismes de réglementation en dehors des États-Unis?
A12. L’Organisation mondiale de la santé a reconnu le lymphome anaplasique à grandes cellules associé à un implant mammaire (BIA-ALCL) comme une forme unique d’ALCL qui peut se développer après l’implantation d’un implant mammaire.
les organisations professionnelles, y compris la Plastic Surgery Foundation et le National Comprehensive Cancer Network (NCCN) ont publié des informations pour aider les médecins à comprendre la maladie et à fournir un diagnostic et un traitement.,
Le 12 février 2019, Santé Canada a annoncé qu’il mettrait à jour son examen de l’innocuité des implants mammaires.
Le 4 avril 2019, L’agence de réglementation des médicaments et des produits de santé a annoncé ses recommandations à l’intention des patients et des fournisseurs de soins de santé.
Le 4 avril 2019, l’Agence Nationale de sécurité du médicament et des produits de santé (ANSM) a annoncé sa décision de retirer, par mesure de précaution, les implants mammaires « macrotexturés » et les implants mammaires à surface revêtue de polyuréthane commercialisés en France., L’ANSM ne recommande pas d’explication préventive pour les femmes portant ces implants
Le 11 juillet 2019, L’Australian Therapeutic Goods Administration (TGA) a annoncé avoir terminé l’évaluation des implants mammaires texturés disponibles en Australie ou exportés d’Australie et proposé des mesures réglementaires.
Q13. Où peut-on trouver plus d’informations?
A13. Des informations supplémentaires peuvent être trouvées dans les communications récentes de la FDA et notre page Web sur les implants mammaires.,
- LA FDA prend des mesures pour protéger les patientes contre le risque de certains Implants mammaires texturés; demande à Allergan de rappeler volontairement certains Implants mammaires et Extenseurs tissulaires du marché: FDA Safety Communication (7/24/2019)
- FDA Breast Implant Information
- Ce Qu’il faut savoir sur les Implants mammaires