Q1. Cosa sa la FDA sul linfoma associato alla protesi mammaria?
A1. La FDA ha identificato per la prima volta una possibile associazione tra le protesi mammarie e lo sviluppo di ALCL nel 2011. A quel tempo, la FDA sapeva di così pochi casi di questa malattia che non era possibile determinare quali fattori aumentavano il rischio., In un rapporto che riassume i risultati dell’Agenzia, abbiamo sottolineato la necessità di raccogliere ulteriori informazioni per caratterizzare meglio ALCL in individui con protesi mammarie. Nel 2016, l’Organizzazione mondiale della sanità ha designato il linfoma anaplastico a grandi cellule associato alla protesi mammaria (BIA-ALCL) come linfoma a cellule T che può svilupparsi dopo le protesi mammarie e ha osservato che il numero esatto di casi è rimasto difficile da determinare a causa di limitazioni significative nella segnalazione mondiale e mancanza di dati globali sulle vendite di protesi mammarie.,
Da quel momento, la FDA ha intrapreso diversi passi per comprendere meglio questo problema, tra cui una revisione approfondita dei dati dello studio post-approvazione, rapporti sui dispositivi medici, letteratura scientifica e registri specifici per le protesi mammarie e discussioni pubbliche. Abbiamo regolarmente comunicato circa i rischi associati con protesi mammarie e sentito da pazienti che sono preoccupati per i loro impianti di essere collegato a varie condizioni di salute. A marzo 2019, abbiamo discusso molte importanti preoccupazioni sulle protesi mammarie in una riunione del comitato consultivo pubblico.
Q2. Che cos’è BIA-ALCL?, È il cancro al seno BIA-ALCL?
A2. Impianto mammario Linfoma associato (BIA – ALCL) non è il cancro al seno-è un tipo di linfoma non-Hodgkin (cancro del sistema immunitario). Nella maggior parte dei casi, BIA-ALCL si trova nel tessuto cicatriziale e nel fluido vicino all’impianto, ma in alcuni casi può diffondersi in tutto il corpo. Il rischio di un individuo di sviluppare BIA-ALCL è considerato basso; tuttavia, questo cancro è grave e può portare alla morte, specialmente se non trattato prontamente., Nella maggior parte dei pazienti, viene trattato con successo con un intervento chirurgico per rimuovere l’impianto e il tessuto cicatriziale circostante, e in alcuni pazienti, anche il trattamento con chemioterapia e radioterapia.
Q3. Quali sono i sintomi di BIA-ALCL?
A3. I principali sintomi di BIA-ALCL sono gonfiore persistente, presenza di una massa o dolore nell’area della protesi mammaria. Questi sintomi possono verificarsi ben dopo che l’incisione chirurgica è guarita, spesso anni dopo il posizionamento dell’impianto.
Dopo la valutazione da parte di un fornitore di assistenza sanitaria, si osserva spesso evidenza di raccolta di liquidi attorno alla protesi mammaria (sieroma)., Alcune segnalazioni dei pazienti indicavano la presenza di un nodulo sotto la pelle o di una contrattura capsulare (capsula cicatriziale spessa e evidente attorno all’impianto).
Q4. Dove nel seno è stato trovato BIA-ALCL?
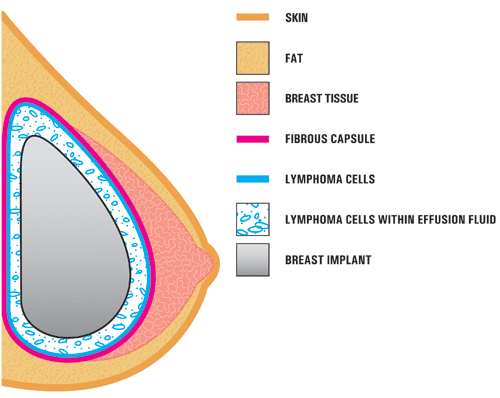
A4. Nei casi di studio riportati in letteratura, BIA-ALCL si trova solitamente vicino alla protesi mammaria, contenuta all’interno della capsula cicatriziale fibrosa, e non nel tessuto mammario stesso. L’illustrazione seguente mostra la posizione dell’ALCL in questi rapporti. Nella maggior parte dei casi, le cellule ALCL sono state trovate nel fluido che circonda l’impianto (sieroma) o contenute all’interno della capsula della cicatrice fibrosa.,
Q5. La struttura superficiale del guscio della protesi mammaria-liscia contro strutturata-aumenta il rischio di una donna di sviluppare BIA-ALCL?
A5. Abbiamo valutato il crescente numero di prove, inclusi nuovi rapporti sui dispositivi medici dagli Stati Uniti e in tutto il mondo sul numero complessivo di casi di BIA-ALCL. Questi includono decessi aggiuntivi solo recentemente segnalati alla FDA e nella letteratura scientifica., Di conseguenza, abbiamo stabilito che:
- Tutti i pazienti che hanno protesi mammarie o stanno pensando di ottenerle devono essere consapevoli del rischio di BIA-ALCL.
- Il rischio di BIA-ALCL è maggiore per gli impianti con superficie strutturata rispetto agli impianti con superficie liscia.
- Alcuni altri prodotti per il seno testurizzati, in particolare alcuni espansori di tessuti testurizzati, non dovrebbero essere utilizzati e abbiamo emesso nuove raccomandazioni per i pazienti che hanno o hanno avuto questi prodotti.
Q6. Alcuni espansori di tessuti testurizzati potrebbero aumentare il rischio di BIA-ALCL?
A6., La FDA ritiene che gli espansori tissutali con una certa superficie strutturata possano essere di preoccupazione. Questi espansori tissutali non devono essere utilizzati e abbiamo emesso nuove raccomandazioni per i pazienti che hanno o hanno avuto questi prodotti. Gli espansori tissutali sono indicati per essere utilizzati solo per 6 mesi e, ad oggi, ci sono informazioni limitate sul fatto che l’esposizione temporanea possa essere associata al rischio di BIA-ALCL. Altri espansori di tessuto che non utilizzano la superficie strutturata di preoccupazione sono prontamente disponibili negli Stati Uniti, Un espansore di tessuto viene utilizzato per allungare la pelle e altri tessuti prima della ricostruzione del seno dopo mastectomia, correzione di un seno sottosviluppato, revisione della cicatrice e procedure di difetto del tessuto. Si tratta di un impianto temporaneo, posto sotto la pelle del seno o muscoli del torace per allungare la pelle e altri tessuti, ed è destinato ad essere sostituito con una protesi mammaria in un secondo momento.
Q7. Il riempimento della protesi mammaria-silicone contro soluzione salina-aumenta il rischio di un individuo di sviluppare BIA-ALCL?
A7., Sulla base dei dati attualmente disponibili, il tipo di riempimento dell’impianto non sembra essere un fattore di rischio per BIA-ALCL, ma questo non è stato valutato in un ampio studio epidemiologico ben progettato. Ad oggi, non ci sono stati dati sufficienti per determinare se ALCL possa essere trovato più o meno frequentemente in individui con protesi mammarie riempite di silicone rispetto a individui con protesi mammarie riempite di soluzione salina.
Q8. Cosa dovrebbero fare gli operatori sanitari e i pazienti?
A8.La FDA raccomanda che gli operatori sanitari continuino a fornire ai loro pazienti assistenza e supporto di routine.,
Operatori sanitari:
- È necessario interrompere immediatamente l’uso (impiantare) le protesi mammarie e gli espansori tissutali elencati nella comunicazione sulla sicurezza FDA del 24 luglio 2019; e lavorare con la struttura per restituire l’inventario esistente.
- Non raccomandiamo la rimozione di routine di questi o altri tipi di protesi mammarie in pazienti che non hanno sintomi.,
- È necessario informare i pazienti che hanno gli impianti e gli espansori tissutali elencati nella comunicazione sulla sicurezza FDA del 24 luglio 2019 sui rischi di gravi conseguenze negative per la salute, incluso il potenziale per lo sviluppo di BIA-ALCL.
- Prima dell’impianto di qualsiasi protesi mammaria, fornire ai pazienti l’etichettatura del paziente del produttore, nonché qualsiasi altro materiale educativo e discutere i benefici e i rischi dei diversi tipi di impianti.
- Considerare la possibilità di BIA-ALCL nel trattamento di un paziente con insorgenza tardiva, cambiamenti peri-implantari., In alcuni casi, i pazienti hanno presentato un sieroma, una massa, un indurimento adiacente alla protesi mammaria. Se hai un paziente con sospetto BIA-ALCL, riferisci il caso del paziente a esperti che hanno familiarità con la diagnosi e il trattamento di BIA-ALCL.
- Raccogliere liquido sieroma fresco e porzioni rappresentative della capsula e inviare per i test di patologia per escludere BIA-ALCL., La valutazione diagnostica deve includere la valutazione citologica del fluido o della massa del sieroma con strisci colorati di Wright Giemsa e test di immunoistochimica/citometria a flusso del blocco cellulare per i marcatori del cluster di differenziazione (CD30) e della chinasi del linfoma anaplastico (ALK).
- Sviluppare un piano di trattamento individualizzato in coordinamento con esperti che hanno familiarità con la diagnosi e il trattamento di BIA-ALCL. Considerare le attuali linee guida sulla pratica clinica, come quelle della Plastic Surgery Foundation o della National Comprehensive Cancer Network (NCCN) quando si sceglie l’approccio terapeutico.,
Pazienti:
- Se non si hanno sintomi, non raccomandiamo la rimozione degli impianti e degli espansori tissutali elencati nella Comunicazione sulla sicurezza FDA del 24 luglio 2019; o altri tipi di protesi mammarie a causa di preoccupazioni legate al rischio di sviluppare BIA-ALCL.
- Conoscere i sintomi di BIA-ALCL, principalmente gonfiore persistente, presenza di una massa o dolore nelle vicinanze della protesi mammaria e monitorare l’area intorno alle protesi mammarie per eventuali modifiche.,
- Se si verifica uno qualsiasi di questi sintomi o altri cambiamenti, parlare con il proprio fornitore di assistenza sanitaria per quanto riguarda la necessità di ulteriori valutazioni. La valutazione per BIA-ALCL comprende tipicamente un esame fisico, una rappresentazione e / o una valutazione del liquido o del tessuto intorno alla protesi mammaria. È importante sottoporsi a una valutazione per diagnosticare BIA-ALCL poiché una diagnosi BIA-ALCL confermata può modificare il tipo di operazione che deve essere eseguita.,
- I pazienti con BIA-ALCL confermato devono essere sottoposti a rimozione dell’impianto con rimozione della capsula cicatriziale circostante, che è un’operazione più ampia rispetto alla sola rimozione dell’impianto.
- Come con qualsiasi dispositivo impiantato, è bene tenere un registro del produttore del dispositivo e del nome del modello di impianto. Potrebbe aver ricevuto queste informazioni su una scheda del dispositivo del paziente dal chirurgo. Se desideri ottenere il nome del produttore e il modello dei tuoi impianti, prendi in considerazione la possibilità di chiedere al tuo chirurgo o di ottenere il record del tuo intervento chirurgico (note operative) dalla struttura in cui è stato eseguito.,
- Comprendere che la maggior parte dei casi di BIA-ALCL si verificano anni dopo il posizionamento della protesi mammaria e presentano sintomi o cambiamenti intorno alla protesi mammaria. Parlate con il vostro chirurgo circa il rischio di sviluppare BIA-ALCL.
- Se state pensando di protesi mammarie, si prega di consultare queste importanti raccomandazioni.
Continueremo a riferire su risultati significativi man mano che nuove informazioni e analisi saranno disponibili.
Q9. Come possono gli operatori sanitari segnalare casi di BIA-ALCL nei loro pazienti?
A9 ., Gli operatori sanitari dovrebbero:
- Segnalare tutti i casi di BIA-ALCL in individui con protesi mammarie a MedWatch, il programma FDA Safety Information and Adverse Event Reporting.
- Il personale sanitario impiegato da strutture soggette ai requisiti di segnalazione delle strutture degli utenti della FDA dovrebbe seguire le procedure di segnalazione stabilite dalle loro strutture. La segnalazione tempestiva di eventi avversi può aiutare la FDA a identificare e comprendere meglio i rischi associati ai dispositivi medici. In alcuni casi, la FDA può contattarti per ulteriori informazioni., La FDA manterrà riservate le identità del personale che riferisce l’evento e del paziente.
- Presentare le segnalazioni di casi di BIA-ALCL al registro del paziente e gli esiti per le protesi mammarie e anaplastico linfoma a grandi cellule eziologia ed epidemiologia (PROFILO) Registro per contribuire a una migliore comprensione delle cause e trattamenti di BIA-ALCL.
Q10. Se un individuo sta prendendo in considerazione le protesi mammarie, cosa dovrebbero fare?
A10. Ci sono diverse cose importanti da considerare prima di decidere di sottoporsi a chirurgia implantare del seno., Questo elenco è disponibile presso la FDA at (cose riviste da considerare prima di ottenere protesi mammarie in rischi e complicazioni) per aiutarti a essere pienamente informato se stai considerando l’aumento del seno, la ricostruzione con un impianto o la revisione (sostituzione) di un impianto che hai già. Ancora più importante, voi e il vostro chirurgo dovrebbe discutere i vostri obiettivi e le aspettative di avere protesi mammarie, i benefici ei rischi, la necessità di monitorare l’impianto per complicazioni per tutto il tempo che li avete, e l’eventuale rimozione o sostituzione.
Q11. Quali azioni continuerà a prendere la FDA?,
A11. La FDA continua a raccogliere e valutare informazioni su BIA-ALCL in individui con protesi mammarie e che hanno utilizzato espansori tissutali.
Su base continuativa, noi:
- Ricevere e rivedere medical Device reports (MDRs).
- Rivedere la letteratura medica corrente.
- Scambiare informazioni con altri regolatori statunitensi e internazionali ed esperti scientifici.,
- Rivedere i dati del Registro del paziente e gli esiti per le protesi mammarie e anaplastico Linfoma a grandi cellule (ALCL) Eziologia ed epidemiologia (Registro PROFILO) (uno sforzo di collaborazione con l’American Society of Plastic Surgeons (ASPS) e la Plastic Surgery Foundation (PSF)).
- Rivedere le informazioni che i produttori di protesi mammarie includono su BIA-ALCL nella loro etichettatura del paziente e del professionista sanitario.
- Rivedere le informazioni fornite da studi post-mercato in corso.
- Monitorare gli eventi avversi da altri dati reali (ad esempio il registro nazionale delle protesi mammarie).,
Q12. Quali azioni sono state intraprese da società professionali e organismi di regolamentazione al di fuori degli Stati Uniti?
A12. L’Organizzazione mondiale della sanità ha riconosciuto il linfoma anaplastico a grandi cellule associato all’impianto mammario (BIA-ALCL) come una forma unica di ALCL che può svilupparsi dopo l’impianto mammario, l’impianto.
Le organizzazioni professionali, tra cui la Plastic Surgery Foundation e la National Comprehensive Cancer Network (NCCN) hanno pubblicato informazioni per aiutare i medici a comprendere la malattia e fornire diagnosi e trattamento.,
A febbraio 12, 2019 Health Canada ha annunciato che aggiornerà la sua revisione della sicurezza delle protesi mammarie.
Il 4 aprile 2019, l’Agenzia di regolamentazione dei medicinali e dei prodotti sanitari ha annunciato le sue raccomandazioni per i pazienti e gli operatori sanitari.
Il 4 aprile 2019, l’Agenzia nazionale francese per i medicinali e la sicurezza dei prodotti sanitari (ANSM) ha annunciato la sua decisione di ritirare, come misura precauzionale, le protesi mammarie “macrotextured” e le protesi mammarie con superfici rivestite in poliuretano commercializzate in Francia., L’ANSM non raccomanda spiegazioni preventive per le donne con questi impianti
L ‘ 11 luglio 2019 L’Australian Therapeutic Goods Administration (TGA) ha annunciato di aver completato la valutazione delle protesi mammarie testurizzate disponibili in Australia o esportate dall’Australia e ha proposto azioni normative.
Q13. Dove possiamo trovare maggiori informazioni?
A13. Ulteriori informazioni possono essere trovate nelle recenti comunicazioni della FDA e nella nostra pagina Web sulle protesi mammarie.,
- La FDA interviene per proteggere i pazienti dal rischio di alcune protesi mammarie testurizzate; Richiede che Allergan richiami volontariamente alcune protesi mammarie e espansori tissutali dal mercato: FDA Safety Communication (24/7/2019)
- FDA Breast Implant Information
- Cosa sapere sulle protesi mammarie