Q1. Ce știe FDA despre limfomul asociat implantului mamar?
A1. FDA a identificat pentru prima dată o posibilă asociere între implanturile mamare și dezvoltarea ALCL în 2011. În acel moment, FDA știa atât de puține cazuri de această boală încât nu a fost posibil să se determine ce factori au crescut riscul., Într-un raport care rezumă constatările Agenției, am subliniat necesitatea de a aduna informații suplimentare pentru a caracteriza mai bine ALCL la persoanele cu implanturi mamare. În 2016, Organizația Mondială a Sănătății a desemnat implant mamar asociate cu limfomul anaplastic cu celule mari (BIA-ALCL), ca un limfom cu celule T, care se pot dezvolta următoarele implanturi mamare și a menționat că numărul exact de cazuri au rămas dificil de a determina cauza limitări semnificative în întreaga lume de raportare și de lipsa de global implant mamar datele de vânzări.,din acel moment, FDA a întreprins mai mulți pași pentru a înțelege mai bine această problemă, inclusiv o revizuire aprofundată a datelor studiului post-aprobare, a rapoartelor despre dispozitivele medicale, a literaturii științifice și a registrelor specifice implantului mamar și a discuțiilor publice. Am comunicat în mod regulat despre riscurile asociate cu implanturile mamare și am auzit de la pacienții care sunt preocupați de faptul că implanturile lor sunt conectate la diferite condiții de sănătate. În martie 2019, am discutat multe probleme importante privind implanturile mamare într-o ședință a Comitetului consultativ public.
Q2. Ce este BIA-ALCL?, Este cancerul de sân BIA-ALCL?
A2. Limfomul asociat implantului mamar (BIA – ALCL) nu este cancer de sân – este un tip de limfom non-Hodgkin (cancer al sistemului imunitar). În cele mai multe cazuri, BIA-ALCL se găsește în țesutul cicatricial și lichidul din apropierea implantului, dar în unele cazuri se poate răspândi în tot corpul. Riscul unui individ de a dezvolta BIA-ALCL este considerat a fi scăzut; cu toate acestea, acest cancer este grav și poate duce la deces, mai ales dacă nu este tratat prompt., La majoritatea pacienților, este tratat cu succes cu o intervenție chirurgicală pentru a îndepărta implantul și țesutul cicatrician înconjurător, iar la unii pacienți, de asemenea, tratamentul cu chimioterapie și radioterapie.
Q3. Care sunt simptomele BIA-ALCL?
A3. Principalele simptome ale BIA-ALCL sunt umflarea persistentă, prezența unei mase sau durere în zona implantului mamar. Aceste simptome pot apărea bine după ce incizia chirurgicală s-a vindecat, adesea la ani după plasarea implantului.în urma evaluării de către un furnizor de servicii medicale, se observă adesea dovezi de colectare a lichidului în jurul implantului mamar (serom)., Unele rapoarte ale pacienților au indicat că a fost prezentă o bucată sub piele sau o contracție capsulară (capsulă cicatricială groasă și vizibilă în jurul implantului).
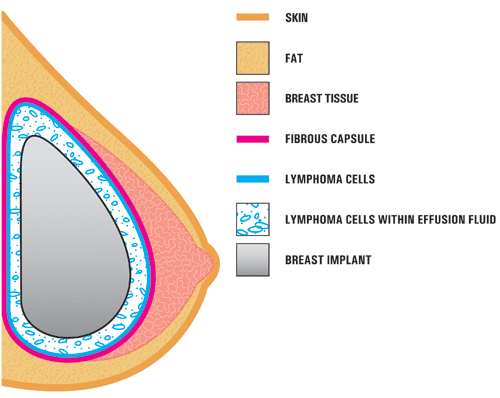
Q4. Unde a fost găsit Bia-ALCL în sân?
A4. În studiile de caz raportate în literatura de specialitate, BIA-ALCL se găsește de obicei în apropierea implantului mamar, conținut în capsula cicatricială fibroasă și nu în țesutul mamar în sine. Ilustrația de mai jos arată locația ALCL în aceste rapoarte. În cele mai multe cazuri, celulele ALCL au fost găsite în lichidul din jurul implantului (serom) sau conținute în capsula cicatricială fibroasă.,
Q5. Textura suprafeței învelișului implantului mamar–netedă versus texturată–crește riscul unei femei de a dezvolta BIA-ALCL?
A5. Am evaluat numărul tot mai mare de dovezi, inclusiv noile rapoarte ale dispozitivelor medicale din SUA și din întreaga lume cu privire la numărul total de cazuri BIA-ALCL. Acestea includ decese suplimentare raportate recent la FDA și în literatura științifică., Ca rezultat, am stabilit că:
- toți pacienții care au implanturi mamare sau se gândesc să le obțină ar trebui să fie conștienți de riscul de BIA-ALCL.
- riscul de BIA-ALCL este mai mare pentru implanturile cu suprafață texturată comparativ cu implanturile cu suprafață netedă.
- anumite alte produse de sân texturate, în special anumite expandoare de țesut texturat, nu ar trebui utilizate și am emis noi recomandări pentru pacienții care au sau au avut aceste produse.
Q6. Ar putea anumiți extensori de țesut texturat să crească riscul de BIA-ALCL?
A6., FDA consideră că extensoarele de țesut cu o anumită suprafață texturată pot fi îngrijorătoare. Aceste expandoare de țesut nu trebuie utilizate și am emis noi recomandări pentru pacienții care au sau au avut aceste produse. Extensoarele tisulare sunt indicate a fi utilizate timp de numai 6 luni și, până în prezent, există informații limitate cu privire la faptul dacă expunerea temporară poate fi asociată cu riscul de BIA-ALCL. Alte expandoare de țesut care nu utilizează suprafața texturată de îngrijorare sunt disponibile în SUA., Un expander de țesut este folosit pielea întinsă și alte țesuturi înainte de reconstrucția sânului după mastectomie, corectarea unui sân subdezvoltat, revizuirea cicatricilor și procedurile de defect de țesut. Este un implant temporar, plasat sub pielea sânului sau mușchii pieptului pentru a întinde pielea și alte țesuturi și este destinat să fie înlocuit cu un implant mamar la o dată ulterioară.
Q7. Umplerea implantului mamar-silicon versus soluție salină-crește riscul unui individ de a dezvolta BIA-ALCL?
A7., Pe baza datelor disponibile în prezent, tipul de umplere a implantului nu pare a fi un factor de risc pentru Bia-ALCL, dar acest lucru nu a fost evaluat într-un studiu epidemiologic mare, bine conceput. Până în prezent, nu au existat date suficiente pentru a determina dacă ALCL poate fi găsit mai mult sau mai puțin frecvent la persoanele cu implanturi mamare umplute cu silicon, comparativ cu persoanele cu implanturi mamare umplute cu soluție salină.
Q8. Ce ar trebui să facă profesioniștii din domeniul sănătății și pacienții?
A8.FDA recomandă ca furnizorii de servicii medicale să continue să ofere pacienților lor îngrijire de rutină și sprijin.,profesioniștii din domeniul sănătății: trebuie să întrerupeți imediat utilizarea (implantarea) implanturilor mamare și a extensoarelor de țesut enumerate în Comunicarea privind siguranța FDA din 24 iulie 2019; și să lucrați cu instalația dvs. pentru a returna inventarul existent.
vom continua să raportăm asupra constatărilor semnificative pe măsură ce devin disponibile noi informații și analize.
Q9. Cum pot profesioniștii din domeniul sănătății să raporteze cazuri de BIA-ALCL la pacienții lor?
A9., Profesioniștii din domeniul sănătății ar trebui:
- să raporteze toate cazurile de BIA-ALCL la persoanele cu implanturi mamare către MedWatch, programul FDA privind siguranța și raportarea evenimentelor Adverse.
- personalul de îngrijire a sănătății angajat de facilități care fac obiectul cerințelor de raportare a facilităților utilizatorilor FDA ar trebui să urmeze procedurile de raportare stabilite de facilitățile lor. Raportarea promptă a evenimentelor adverse poate ajuta FDA să identifice și să înțeleagă mai bine riscurile asociate dispozitivelor medicale. În unele cazuri, FDA vă poate contacta pentru informații suplimentare., FDA va păstra identitatea personalului care raportează evenimentul și a pacientului confidențial.
- Trimiteți rapoarte de caz de BIA-ALCL la Registrul pacientului și rezultatele pentru implanturile mamare și registrul etiologiei și epidemiologiei limfomului anaplazic cu celule mari (profil) pentru a contribui la o mai bună înțelegere a cauzelor și tratamentelor BIA-ALCL.
Q10. Dacă o persoană are în vedere implanturile mamare, ce ar trebui să facă?
A10. Există mai multe lucruri importante să ia în considerare înainte de a decide să se supună chirurgie implant mamar., Această listă este disponibilă de la FDA la (lucrurile revizuite să ia în considerare înainte de a obține implanturi mamare în riscuri și complicații) pentru a vă ajuta să fie pe deplin informat dacă aveți în vedere marirea sanilor, reconstrucție cu un implant, sau revizuire (înlocuire) a unui implant aveți deja. Cel mai important, tu și chirurgul dvs. ar trebui să discutați obiectivele și așteptările dvs. cu privire la implanturile mamare, beneficiile și riscurile, necesitatea de a vă monitoriza implantul pentru complicații atâta timp cât le aveți și eventuala îndepărtare sau înlocuire.
Q11. Ce acțiuni va continua FDA să ia?,
A11. FDA continuă să colecteze și să evalueze informații despre BIA-ALCL la persoanele cu implanturi mamare și care au folosit extensoare de țesut.
în mod continuu, noi:
- primim și revizuim rapoartele privind dispozitivele medicale (MDRs).
- examinați literatura medicală actuală.
- schimb de informații cu alte autorități de reglementare din SUA și internaționale și experți științifici.,
- examinați datele din Registrul pacientului și rezultatele pentru implanturile mamare și limfomul anaplazic cu celule mari (ALCL) etiologie și Epidemiologie (registrul de profil) (un efort de colaborare cu Societatea Americană a Chirurgilor Plastici (ASPS) și Fundația pentru Chirurgie Plastică (PSF)).
- examinați informațiile pe care producătorii de implant mamar le includ despre Bia-ALCL în etichetarea lor profesională pentru pacienți și sănătate.
- examinați informațiile furnizate din studiile post-piață în curs de desfășurare.
- monitorizați reacțiile adverse din alte date din lumea reală (de exemplu, Registrul Național al implanturilor mamare).,
Q12. Ce acțiuni au fost întreprinse de societățile profesionale și organismele de reglementare din afara SUA?
A12. Organizația Mondială a Sănătății a recunoscut limfomul anaplazic cu celule mari asociat implantului mamar (BIA-ALCL) ca o formă unică de ALCL care se poate dezvolta în urma implantului mamar, implantarea.organizațiile profesionale, inclusiv Fundația pentru Chirurgie Plastică și rețeaua națională cuprinzătoare de Cancer (NCCN) au publicat informații pentru a ajuta medicii să înțeleagă boala și să ofere diagnostic și tratament.,
în februarie 12, 2019 Health Canada a anunțat că va actualiza revizuirea siguranței implanturilor mamare.pe 4 aprilie 2019, Agenția de reglementare a medicamentelor și produselor medicale și-a anunțat recomandările pentru pacienți și furnizorii de servicii medicale.la 4 aprilie 2019, Agenția Națională franceză pentru medicamente și siguranța produselor de sănătate (ANSM) și-a anunțat decizia de a se retrage, ca măsură de precauție, din implanturile mamare „macrotexturate” și implanturile mamare cu suprafețe acoperite cu poliuretan comercializate în Franța., ANSM nu recomandă explicații preventive pentru femeile cu aceste implanturi
în iulie 11, 2019 Australian therapeutic Goods Administration (TGA) a raportat că a finalizat evaluarea implanturilor mamare texturate disponibile în Australia sau exportate din Australia și a propus acțiuni de reglementare.
Q13. Unde putem găsi mai multe informații?
A13. Informații suplimentare pot fi găsite în FDA recente comunicări și site-ul nostru implant mamar.,
- FDA Ia Măsuri pentru a Proteja Pacienții la Risc pentru Anumite Texturate Implanturile Mamare; Solicită Allergan Voluntar Amintesc Anumite Implanturi Mamare și Extensori de Țesut de pe Piață: FDA Comunicare în materie de Siguranță (7/24/2019)
- FDA Implant Mamar Informații
- Ce trebuie sa Stim Despre Implanturile Mamare