încărcarea formală și structura Lewis
legăturile covalente dintr-o moleculă și sarcina generală a unei molecule pot fi vizualizate cu structuri Lewis dot.
Obiectivele de Învățare
Calcula taxele oficiale pe atomi dintr-un compus
Takeaways Cheie
Puncte-Cheie
- structuri Lewis, de asemenea, numit Lewis dot diagrame, model legare covalentă între atomi. Aceste diagrame folosesc puncte în jurul atomilor pentru a semnifica electroni și linii pentru a semnifica legăturile dintre atomi.,
- structurile Lewis încorporează sarcina formală a unui atom, care este sarcina pe un atom dintr-o moleculă, presupunând că electronii dintr-o legătură chimică sunt împărțiți în mod egal între atomi.
- când mai multe structuri Lewis pot reprezenta același compus, formulele Lewis diferite sunt numite structuri de rezonanță.
termeni cheie
- sarcină formală: sarcina atribuită unui atom dintr-o moleculă, presupunând că electronii dintr-o legătură chimică sunt împărțiți în mod egal între atomi. Acest lucru ajută la determinarea care dintre câteva structuri Lewis este cea mai corectă.,
- regula octetului: atomii pierd, câștigă sau împart electroni pentru a avea o coajă de valență completă de opt electroni.
- structura de rezonanță: o moleculă sau un ion poliatomic care are mai multe structuri Lewis, deoarece legarea poate fi arătată în mai multe moduri.reprezentările picturale sunt adesea folosite pentru a vizualiza electronii, precum și orice legătură care poate apărea între atomii dintr-o moleculă. În special, chimiștii folosesc structuri Lewis (cunoscute și sub denumirea de diagrame Lewis dot, diagrame cu puncte electronice sau structuri electronice) pentru a reprezenta compuși covalenți., În aceste diagrame, electronii de valență sunt arătați ca puncte care stau în jurul atomului; orice legături pe care atomii le împărtășesc sunt reprezentate de linii simple, duble sau triple.
Lewis dot structura de carbon: Un exemplu tipic de Lewis structura de carbon, cu electroni de valență notat ca puncte jurul atomului. în general, majoritatea structurilor Lewis urmează regula octetului; ei vor împărți electroni până când vor atinge 8 electroni în cochilia lor de valență exterioară., Cu toate acestea, există excepții de la regula octetului, cum ar fi borul, care este stabil cu doar 6 electroni în carcasa sa de valență. Elementele hidrogen (H) și heliu (He) urmează regula duetului, care spune că învelișul lor de valență exterioară este plin cu 2 electroni în el.pentru a desena o structură Lewis, trebuie determinat numărul de electroni de valență pe fiecare atom din compus. Numărul total de electroni de valență din întregul compus este egal cu suma electronilor de valență ai fiecărui atom din compus., Electronii de non-valență nu sunt reprezentați la desenarea structurilor Lewis.electronii de valență sunt plasați ca perechi singuratice (doi electroni) în jurul fiecărui atom. Majoritatea atomilor pot avea un octet incomplet de electroni. Cu toate acestea, atomii pot împărți electroni între ei pentru a îndeplini această cerință octet. O legătură care împarte doi electroni se numește o singură legătură și este semnificată de o linie dreaptă, orizontală.
dacă regula octetului nu este încă îndeplinită, atomii pot forma o legătură dublă (4 electroni împărțiți) sau triplă (6 electroni împărțiți)., Deoarece perechea de legătură este împărțită, atomul care a avut perechea singuratică are încă un octet, iar celălalt atom câștigă doi sau mai mulți electroni în carcasa sa de valență.de exemplu, CO2 este o moleculă neutră cu 16 electroni de valență totală. În structura Lewis, carbonul trebuie să fie dublu legat de ambii atomi de oxigen.

structura Lewis pentru dioxidul de carbon: Această diagramă arată conceptual etape de desen structura Lewis pentru o moleculă de dioxid de carbon (CO2). structurile Lewis pot fi, de asemenea, desenate pentru ioni., În aceste cazuri, întreaga structură este plasată în paranteze, iar încărcarea este scrisă ca un superscript în partea dreaptă sus, în afara suportului.

structura Lewis pentru ionul de hidroxid: În ionul de hidroxid (OH–), întreaga structură este înconjurat de un suport, iar taxa este plasat în afara suportului. deși știm câți electroni de valență sunt prezenți într-un compus, este mai greu de determinat în jurul atomilor pe care se află efectiv electronii., Pentru a ajuta la această problemă, chimiștii calculează adesea sarcina formală a fiecărui atom. Sarcina formală este sarcina electrică pe care un atom ar avea-o dacă toți electronii ar fi împărțiți în mod egal.
acuzație formală a unui atom poate fi determinată prin următoarea formulă:
FC = V – (N + \frac{B}{2})
În această formulă, V reprezintă numărul de electroni de valență a atomului izolat, N este numărul de non-lipire electroni de valență, iar B este numărul total de electroni în legături covalente cu alți atomi în moleculă.,
De exemplu, să se calculeze taxa oficială pe un atom de oxigen într-un dioxid de carbon (CO2) moleculă:
FC = 6 electroni de valență – (4 non-aderenta electroni de valență + 4/2 electroni în legături covalente)
FC = 6 – 6 = 0
atomul De oxigen din dioxidul de carbon are o taxa oficială de 0.uneori, mai multe structuri Lewis pot fi trase pentru a reprezenta același compus. Aceste structuri echivalente sunt cunoscute ca structuri de rezonanță și implică deplasarea electronilor și nu a atomilor reali., În funcție de compus, deplasarea electronilor poate provoca o schimbare a sarcinilor formale. Cel mai adesea, structurile Lewis sunt desenate astfel încât sarcina formală a fiecărui atom este minimizată.
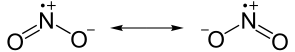
structuri de rezonanță: două dintre structurile care contribuie la dioxidul de azot (NO2). Ambele formule reprezintă același număr de atomi și electroni, doar într-o conformație ușor diferită.

