carga Formal y estructura de Lewis
los enlaces covalentes en una molécula y la carga general de una molécula se pueden visualizar con estructuras de punto de Lewis.
objetivos de aprendizaje
calcular las cargas formales sobre los átomos en un compuesto
conclusiones clave
puntos clave
- Las estructuras de Lewis, también llamadas diagramas de puntos de Lewis, modelan la unión covalente entre los átomos. Estos diagramas usan puntos alrededor de los átomos para significar electrones y líneas para significar enlaces entre átomos.,
- Las estructuras de Lewis incorporan la carga formal de un átomo, que es la carga sobre un átomo en una molécula, asumiendo que los electrones en un enlace químico se comparten por igual entre los átomos.
- Cuando múltiples estructuras de Lewis pueden representar el mismo compuesto, las diferentes fórmulas de Lewis se llaman estructuras de resonancia.
términos clave
- carga formal: la carga asignada a un átomo en una molécula, suponiendo que los electrones en un enlace químico se comparten por igual entre los átomos. Esto ayuda a determinar cuál de las pocas estructuras de Lewis es la más correcta.,
- regla de octeto: los átomos pierden, ganan o comparten electrones para tener una capa de Valencia completa de ocho electrones.
- Estructura de resonancia: una molécula o ion poliatómico que tiene múltiples estructuras de Lewis porque la Unión puede mostrarse de múltiples maneras.
las estructuras de Lewis
las representaciones pictóricas se utilizan a menudo para visualizar electrones, así como cualquier enlace que pueda ocurrir entre átomos en una molécula. En particular, los químicos usan estructuras de Lewis (también conocidas como diagramas de puntos de Lewis, diagramas de puntos de electrones o estructuras de electrones) para representar compuestos covalentes., En estos diagramas, los electrones de Valencia se muestran como puntos que se sientan alrededor del átomo; cualquier enlace que los átomos compartan está representado por líneas simples, dobles o triples.

La estructura de puntos de Lewis del carbono: una estructura típica de Lewis del carbono, con los electrones de Valencia denotados como puntos alrededor del átomo.
generalmente, la mayoría de las estructuras de Lewis siguen la regla del octeto; compartirán electrones hasta que logren 8 electrones en su capa de Valencia más externa., Sin embargo, hay excepciones a la regla del octeto, como el boro, que es estable con solo 6 electrones en su envoltura de Valencia. Los elementos hidrógeno (H) y helio (He) siguen la regla del dúo, que dice que su capa de Valencia más externa está llena con 2 electrones en ella.
dibujar una estructura de Lewis
para dibujar una estructura de Lewis, se debe determinar el número de electrones de Valencia en cada átomo del compuesto. El número total de electrones de valencia en todo el compuesto es igual a la suma de los electrones de valencia de cada átomo en un compuesto., Los electrones sin Valencia no se representan al dibujar las estructuras de Lewis.
Los electrones de Valencia se colocan como pares solitarios (dos electrones) alrededor de cada átomo. La mayoría de los átomos pueden tener un octeto incompleto de electrones. Sin embargo, los átomos pueden compartir electrones entre sí para cumplir con este requisito de octeto. Un enlace que comparte dos electrones se llama enlace simple y se significa por una recta, línea horizontal.
si la regla del octeto todavía no se cumple, los átomos pueden formar un enlace doble (4 electrones compartidos) o triple (6 electrones compartidos)., Debido a la unión de par es compartida, el átomo, que tenía el par solitario todavía tiene un octeto, y el otro átomo gana dos o más electrones en su valencia shell.
por ejemplo, el CO2 es una molécula neutra con 16 electrones de Valencia totales. En la estructura de Lewis, el carbono debe ser enlazado doble a ambos átomos de oxígeno.

La estructura de Lewis para el dióxido de carbono: este diagrama muestra las etapas conceptuales del dibujo de la estructura de Lewis para una molécula de dióxido de Carbono (CO2).
Las estructuras de Lewis también se pueden dibujar para iones., En estos casos, toda la estructura se coloca entre paréntesis, y la carga se escribe como un superíndice en la parte superior derecha, fuera del paréntesis.

La estructura de Lewis para el ion hidróxido: en el ion hidróxido (OH–), toda la estructura está rodeada por un soporte, y la carga se coloca fuera del soporte.
determinar la carga Formal
aunque sabemos cuántos electrones de Valencia están presentes en un compuesto, es más difícil determinar alrededor de qué átomos residen realmente los electrones., Para ayudar con este problema, los químicos a menudo calculan la carga formal de cada átomo. La carga formal es la carga eléctrica que tendría un átomo si todos los electrones fueran compartidos por igual.
la carga formal de un átomo puede ser determinada por la siguiente fórmula:
FC = V – (N + \frac{B}{2})
en esta fórmula, V representa el número de electrones de Valencia del átomo en AISLAMIENTO, N es el número de electrones de Valencia no enlazantes, y B es el número total de electrones en enlaces covalentes con otros átomos en la molécula.,
por ejemplo, calculemos la carga formal en un átomo de oxígeno en una molécula de dióxido de Carbono (CO2):
FC = 6 electrones de Valencia – (4 electrones de Valencia no enlazantes + 4/2 electrones en enlaces covalentes)
FC = 6-6 = 0
El átomo de oxígeno en dióxido de carbono tiene una carga formal de 0.
estructuras de resonancia
a veces se pueden dibujar múltiples estructuras de Lewis para representar el mismo compuesto. Estas estructuras equivalentes se conocen como estructuras de resonancia e implican el desplazamiento de electrones y no de átomos reales., Dependiendo del compuesto, el desplazamiento de electrones puede causar un cambio en las cargas formales. Muy a menudo, las estructuras de Lewis se dibujan de modo que la carga formal de cada átomo se minimiza.
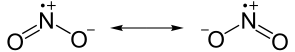
estructuras de resonancia: dos de las estructuras contribuyentes de dióxido de nitrógeno (NO2). Ambas fórmulas representan el mismo número de átomos y electrones, solo que en una conformación ligeramente diferente.