algunas especies de Anolis exhiben dimorfismo trófico, que puede involucrar identidad de ítem (Rodríguez 2010), cantidad de presas, frecuencia y volumen (Perry 1996). En estos casos, las diferencias podrían estar relacionadas con el dimorfismo del tamaño sexual (Tamaño del cuerpo y dimensiones de la cabeza) (Schoener 1968), el comportamiento de forrajeo (relacionado con las diferencias en los roles sexuales masculinos y femeninos) (Butler y Losos 2002, Butler et al., 2007, Perry 1996, Steffen 2009, Vincent y Herrel 2007), variación en el uso de la perca (Perry 1996, Schoener 1967), densidad de población (Stamps et al. 1997), o diferencias en las necesidades energéticas durante la temporada reproductiva (Schoener 1968, Vitt y Zani 1998).
Las dietas de los anoles varían entre y dentro de las especies, y al menos parte de esta variación parece estar relacionada con las diferencias en el uso de recursos estructurales (tipo de perca y altura) y el acceso relacionado, y la abundancia de diferentes presas (Fleming y Hooker 1975, Vitt y Zani 1998, Vitt et al. 2002, 2003b)., Dentro de las especies se ha registrado variación en la ecología de alimentación en anoles amazónicos como A. trachyderma (Vitt et al. 2002), A. punctatus y A. transversalis (Vitt et al. 2003a), y A. fuscoauratus (Vitt et al. 2003b).
la variación geográfica en factores como las interacciones interespecíficas competitivas, la disponibilidad de presas y el uso de recursos estructurales se ha sugerido como la causa subyacente de la variación intraespecífica en los hábitos alimenticios de estas especies (Fleming y Hooker 1975, Gutiérrez y Rumiz 2002, Régnière 2009, Rodríguez 2010, Schoener 1968) y lagartos en general (Aun et al. 1999).,
Anolis ventrimaculatus Boulenger 1911 es una especie Andina de Altiplano distribuida por todo el oeste de Colombia. Esta especie exhibe dimorfismo de tamaño sexual y forma corporal, que también varía entre localidades(Calderón-Espinosa et al. 2013). El dimorfismo en esos rasgos sugiere diferencias en el uso de recursos entre los sexos y, posiblemente, al menos alguna variación entre las poblaciones. Evaluamos esta hipótesis describiendo las dietas de machos y hembras en diferentes localidades dentro del rango de la especie.,
materiales y métodos
Se midió la longitud de ventilación del hocico (SVL) de cada individuo con una pinza digital de 0,1 mm y se eliminaron los estómagos y las porciones proximales de los intestinos. Los estómagos y el contenido intestinal se identificaron por orden y familia cuando fue posible, siguiendo a Triplehorn y Johnson (2005). Luego estimamos el número de presas usando cabezas, alas, patas, antenas y otras partes identificables del cuerpo. Dado que las presas estaban parcialmente digeridas, no pudimos estimar el tamaño de la presa. Posteriormente en este documento, «elemento» se refiere a la identidad taxonómica (e. g.,, Orthoptera, Coleoptera), mientras que «presa» se refiere a presas individuales ingeridas por lagartos.
análisis de datos. Se evaluó el dimorfismo dietético a nivel de especie y localidad comparando el número y la frecuencia de los ítems observados (los identificados a nivel de orden) entre sexos mediante pruebas de Chi cuadrado. El número de presas fue comparado por pruebas t, después de evaluar cualquier relación con el SVL de lagarto usando pruebas de correlación de Spearman (Zaar 1990). También se analizaron los porcentajes de uso de ítems que representaban > 70% de ingesta, y se utilizó la prueba t para compararlos entre sexos., El uso de presas se derivó del número de presas por objeto por individuo/número total de presas ingeridas por cada individuo.
también se analizó la variación geográfica mediante la prueba ANOVA y a posteriori de Tukey para comparar dietas de mujeres y hombres y el porcentaje de uso de ítems que representaban > 70% de ingesta en las distintas localidades.
la normalidad y la homocedasticidad se evaluaron para todos los datos y se transformaron a Log10 los que no cumplían los supuestos. Los análisis de los datos se realizaron en Statistica ver. 8.0 (demo).,
amplitud de nicho trófico, superposición de nicho e índices de dominancia. Estimamos la amplitud del nicho trófico para machos y hembras usando el índice inverso de Simpson (1949) de la siguiente manera: B = (Σpi2)-1,
donde P representa el porcentaje de uso del ítem i. también determinamos si machos y hembras usaron recursos alimenticios similares estimando la superposición del nicho como lo propuso Pianka (1973):
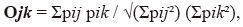
donde pij pik representa porcentaje de utilización del recurso I por mujeres (J) y hombres (K). Estos índices se calcularon utilizando el software Ecosim.,
finalmente, se estimó el índice Lambda de dominancia (Aun et al. 1999, Montori 1988, 1991, 1992) como sigue:
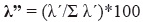
en esta ecuación, λ’ = λ/n*100 y λ = Σpi2,
resultados
Todos los 118 individuos examinados tuvieron alguna ingestión en estómagos e intestinos proximales. Un total de 1021 presas, (593 en hembras y 428 en machos) fueron clasificadas en 16 ítems a nivel ordinal de insectos, arácnidos (Araneae), miriápodos y crustáceos (los isópodos estaban presentes en una hembra)., Los himenópteros y coleópteros, que exhibieron la mayor diversidad Taxonómica a nivel familiar, fueron clasificados en 24 familias. Algunos individuos habían ingerido material vegetal identificado como Marchantiophyta, cobertizo y piedras pequeñas. Estos fueron considerados incidentales, ya que se observaron solo en tres individuos (tabla 1) y presumiblemente fueron ingeridos adventiciosamente.,
estos lagartos se alimentan principalmente de coleópteros, himenópteros (principalmente hormigas) y larvas de insectos, con los coleópteros clasificados como un elemento primario, mientras que los himenópteros y las larvas se clasificaron como elementos secundarios, y otros se consideraron accidentales (tabla 1). La mayoría de los estómagos de todas las localidades contenían nematodos parásitos no identificados.
dimorfismo Sexual y dieta. Se observaron catorce ítems en estómagos de cada sexo. Hombres y mujeres se habían alimentado con el mismo número de ítems (X2 = 1.37, p > 0.05). Sin embargo, algunos ítems fueron observados en hombres o mujeres solamente., Los isópodos y los isópteros (presas pequeñas y en su mayoría terrestres) se encontraron solo en una y dos hembras, respectivamente, mientras que los tricópteros y los neuropteros (presas grandes y en su mayoría arbóreas) estaban presentes solo en dos machos de diferentes localidades. A pesar de estas diferencias, las dietas masculinas y femeninas fueron muy similares, como lo indica la muy alta superposición de nichos (0,99). Los nichos de pan eran 6,09 para los hombres y 6,17 para las mujeres.
hombres y mujeres de la localidad uno presentaron diferentes porcentajes de uso de ortopteros (t = 3,76, p = 0,002) e himenópteros (t = 2,44, p = 0.,02), y los de la localidad seis ingirieron diferentes cantidades de ortopteros (t = 2.24, p = 0.04). En la localidad dos, solo las hembras se alimentaban de ortopteros. Los hombres y las mujeres de otras localidades no difieren significativamente en el uso de estos artículos.
variación geográfica. Solo aquellos ítems que fueron aparentemente exclusivos de hombres o mujeres, y presentes en muy bajas frecuencias y bajos porcentajes de uso exhibieron variación geográfica., Se observaron isópodos solo en la localidad uno, se encontraron isópteros en dos hembras en la localidad seis, tricópteros en la localidad tres, neuropteros en la localidad dos, Blattodea en las localidades dos y seis, miriápodos en las localidades tres y seis, y colémbolos en las localidades tres y cuatro (figura 1).
Los machos comieron números similares de presas en todas las localidades, pero las hembras no (F60, 5 = 3.56, p = 0.007) con diferencias significativas observadas entre las hembras en la localidad uno y las de las localidades tres, cuatro y cinco (prueba de Tukey, p < 0.05).,
discusión
Anolis ventrimaculatus es un insectívoro al igual que la mayoría de las otras especies de Anolis, incluyendo A. tolimensis (Ardila-Marín et al. 2008), A. homolechis (Rodríguez 2010), A. cybotes (Fobes et al. 1992), y A. aeneus (Stamps et al. 1997). Los coleópteros, himenópteros y larvas de insectos fueron los artículos más consumidos, probablemente porque estos artículos son más abundantes(Fobes et al. 1992). Nuestros resultados también sugieren que esta especie puede ser considerada un generalista/oportunista dietético que se alimenta principalmente en perchas de árboles, y rara vez en el suelo.,
los nematodos que se encuentran en el estómago y el contenido intestinal son parásitos comunes en los lagartos de Anolis (Fobes et al. 1992, Goldberg y Bursey 2002, Lenart et al. 1994). La carga parasitaria podría influir en el éxito reproductivo y el comportamiento de los lagartos(Suzán-Azpiril et al. 2008), pero esa información no está disponible para A. ventrimaculatus.
Las diferencias sexuales en la dieta fueron mínimas y se relacionaron principalmente con el número de presas, con los machos probablemente comiendo presas más grandes, lo que explica el menor número de presas ingeridas en comparación con las hembras, y como se observó en otros anoles (p. ej.,, Perry 1996, Rodríguez 2010, Schoener 1967, 1968). Aunque no se determinó formalmente debido a la digestión parcial de ingesta, las diferencias en el tamaño de la presa fueron sugeridas por algunos artículos muy grandes que se encuentran solo en los machos (Montealegre 1997, Triplehorn y Johnson 2005).
Las diferencias menores observadas entre sexos son similares a las observadas en A. trachyderma (Vitt et al. 2002) y A. aeneus y A. richardii (Simmons et al. 2005)., Algunas de las diferencias, como el número de presas o el porcentaje de uso de artículos, podrían estar relacionadas con diferencias en la disponibilidad de presas atribuibles al uso de microhábitatos estructurales diferentes entre sexos, como lo sugiere la variación en el tamaño corporal y el dimorfismo de la forma (Calderón-Espinosa et al. 2013). Sin embargo, el uso de microhábitat o la disponibilidad de presas en esta especie no se ha descrito, y las causas que subyacen a las diferencias sexuales menores en la dieta de A. ventrimaculatus siguen siendo desconocidas.,
la variación geográfica observada en la identidad de los ítems dentro de los machos y dentro de las hembras podría ser explicada como un efecto de tamaño muestral, ya que esta variación involucró solo aquellos ítems, encontrados a muy bajas frecuencias en cada localidad. Estos ítems se han observado en la dieta de otras especies a bajas frecuencias similares(Ardila-Marín et al. 2008, Rodríguez 2010).
El número Total de presas varió solo entre las hembras de diferentes localidades., El consumo de cantidad de alimentos podría estar relacionado con la condición reproductiva de los individuos, ya que los requerimientos energéticos de las hembras grávidas son diferentes a los de las hembras no grávidas (Andrews y Asato 1977, Losos 2009, Rodríguez 2010). Sin embargo, la mayoría de las mujeres incluidas en este estudio eran grávidas, solo tres estaban en una etapa vitelogénica temprana y una era postgravídica. En consecuencia, la variación en la cantidad de alimentos ingeridos por las hembras aparentemente no estaba relacionada con los requisitos energéticos para el desarrollo del folículo o el huevo.,
Además, las fluctuaciones estacionales en la disponibilidad de presas podrían afectar los hábitos de alimentación de estos lagartos. Las densidades de insectos y otros invertebrados generalmente fluctúan entre estaciones (Régnière 2009), afectando la disponibilidad de presas para lagartos, como se describe para A. homolequis (Rodríguez 2010), A. cupreus (Fleming y Hooker 1975), y otras especies de este grupo (Aun et al. 1999).
nuestro estudio representa un primer esfuerzo para comprender los efectos del dimorfismo del tamaño y la forma del cuerpo, y la variación geográfica en un anole Andino., Sin embargo, se necesitan datos ecológicos adicionales para explicar la variación dietética menor observada en esta especie.
reconocimientos
Este estudio fue posible gracias al acceso a especímenes preservados almacenados en la colección de reptiles del Instituto de Ciencias Naturales, UN. Agradecemos A C. Sarmiento, G. Amat, E. Flores, J. H. García, D. Martínez y F. Fernández por ayudar en la identificación de artrópodos y a J. Uribe por ayudar a identificar el contenido vegetal de los estómagos de lagartijas. Una revisión anónima mejoró este manuscrito.
Andrews RM, Asato T. 1977., Energy utilization of a tropical lizard. Comparative Biochemistry and Physiology, 58A: 57-62.
Boulenger GA. 1911. Descriptions of new reptiles from the Andes of South America, preserved in the British Museum. The Annals and Magazine of Natural History, 8th series, 7( 37): 19-25. Butler MA, Losos JB. 2002. Multivariate sexual dimorphism, sexual selection, and adaptation in Greater Anyllean Anolis lizards. Monografías Ecológicas, 72 (4): 541- 559.
Calderón-Espinosa ML, Ortega-León a, Zamora-Abrego JG. 2013., Variación intraespecífica en las dimensiones del tamaño corporal en una especie de anole de las tierras altas Andinas (Anolis ventrimaculatus: Squamata, Dactyloidae). Revista de Biología Tropical, 61 (1): 255-262.
Eaton JM, Larimer SC, Howard KG, Powell R Parmerlee JS Jr. 2002. Population densities and ecological release of the solitary lizard Anolis gingivinus in Anguilla, West Indies. Caribbean Journal of Science, 38 (1): 27-36. Gutiérrez T, Rumiz D. 2002. Patrones de diversidad de grupos selectos de insectos en el bosque chiquitano y pampas del cerrado de Santiago y Tucavaca, Santa Cruz, Bolivia., Revista Boliviana de Ecología, 11 (1): 37-46. Henderson EW, Powell R. 2009. Natural history of West Indian reptiles and amphibians (en inglés). Gainesville (Florida): University of Florida Press. P. 495.
Lenart la, Powell R, Parmelee JS Jr, Smith DD, Lathrop A. 1994. Diet and a gastric parasite of Anolis armouri, a cybotoid anole from montane pine forests in southern Hispaniola. Herpetological Natural History, 2 (1): 97-100.
Perry G. 1996., The evolution of sexual dimorphism in the lizard Anolis polylepis (Iguania): evidence from intraespecific variation in foraging behavior and diet. Canadian Journal of Zoology, 74 (7): 1238-1245.
Pianka ER. 1973. The structure of lizard communities. Annual Review of Ecology and Systematics, 4: 53-74.
Régnière J. 2009. Predicción de la distribución continental de insectos a partir de la fisiología de las especies. Unasylva, 60 (1): 231-232.
Schoener TW. 1967. The ecological significance of sexual dimorphism in size in the lizard Anolis conspersus., Science, 155 (3761): 474-477. Simpson eh. 1949. Medición de la diversidad. Nature, 163: 688.
Sellos JA, Losos JB, Andrews RM. 1997. A comparative study of population density and sexual size dimorphism in lizards. The American Naturalist, 149 (1): 126-135.
Steffen JE. 2009. An assessment of alometry for sexual size dimorphism in mainland anoles. South American Journal of Herpetology, 4 (3): 245-252.
Suzán-Azpiril G, Galindo-Maldonado F, Ceballos-González G. 2008. La importancia del estudio de enfermedades en la conservación de la fauna silvestre., Veterinaria México, 31 (3): 223-230.
Vincent se, Herrel A. 2007. Funcional y ecológica de los correlatos de la base ecológica dimorfismo en los reptiles escamosos. Integrative and Comparative Biology, 47( 2): 172-188.
Vitt LJ, Zani PA. 1998. Uso de presas entre especies de lagartijas simpátricas en la selva tropical de tierras bajas de Nicaragua. Journal of Tropical Ecology, 14 (4): 537-559.
Vitt LJ, Avila T, Zani PA, Espósito C. 2002. Life in shade: the ecology of Anolis trachyderma (Squamata: Polychrotidae) in Amazonian Ecuador and Brazil, with comparisons to ecologically similar anoles., Copeia, 2002 (2): 275-286.
Vitt LJ, Avila T, Zani PA, Sartorius s, Esposito C. 2003b. Life above ground: Ecology of Anolis fuscoauratus in the Amazon rain forest, and comparisons with its nearest relatives. Canadian Journal of Zoology, 81 (1): 142-156.
Zaar JH. 1990. Biostatistical análisis. 4th ed. Upper Saddle River, Nueva Jersey: Prentice-Hall Press. P. 663.