Publicado: 22 de diciembre de 2014
sistema de Alerta Temprana Trans-Tasman – comunicación de alerta
domperidona (Motilium, Prokinex) – conclusión de la revisión de beneficios y riesgos de daño
productos afectados
información para consumidores y cuidadores
información para profesionales de la salud
resumen de la revisión
¿Qué acciones está tomando Medsafe?
Cómo informar de eventos adversos
Más información
Domperidone es un medicamento contra las náuseas que tiene propiedades gastroprocinéticas., Domperidone se utiliza para tratar:
- síntomas dispépticos que pueden estar asociados con el vaciamiento gástrico retrasado (por ejemplo, sensación epigástrica de plenitud, distensión abdominal o hinchazón, o dolor o malestar epigástrico), y
- síntomas agudos de náuseas y vómitos.
investigaciones recientes han sugerido un aumento del riesgo de prolongación del intervalo QT (alteración de la actividad eléctrica del corazón), arritmias (latidos cardíacos inestables) y muerte cardíaca súbita con el uso de domperidona oral.
Medsafe expuso estas preocupaciones en una comunicación de seguimiento publicada en marzo de 2014., Debido a estas preocupaciones, Medsafe y el Comité de reacciones adversas a medicamentos (MARC) revisaron los beneficios y riesgos de los daños de los medicamentos que contienen domperidona.
comunicación de monitorización: domperidona (Motilium, Prokinex) y efectos sobre el corazón
medicamentos reacciones adversas actas de la 158ª reunión del Comité
Medsafe y el MARC han llegado a la conclusión de que existe un pequeño aumento del riesgo de efectos adversos al corazón. Sin embargo, el balance de beneficios y daños potenciales de la domperidona sigue siendo favorable., Los datos disponibles sugieren que este pequeño aumento del riesgo puede ser mayor en pacientes mayores de 60 años o con dosis diarias totales de más de 30 mg.
a pesar del apoyo del MARC para mantener una dosis diaria máxima recomendada de 80 mg, Janssen (fabricante de la marca Motilium de domperidona) ha llegado a la conclusión de que la dosis máxima recomendada debe reducirse de 80 mg a 40 mg diarios. Este cambio de dosis y otros cambios y adiciones a las hojas de datos de domperidona se han recomendado para controlar los riesgos potenciales para el corazón asociados con el uso de domperidona.,
productos afectados
| nombre del producto | patrocinador |
|---|---|
| Motilium | Janssen-Cilag (New Zealand) Ltd |
| prokinex | air flow Products Limited |
información para consumidores y cuidadores
- Para la mayoría de las personas, tomar domperidona es seguro. Sin embargo, si tiene problemas cardíacos o está tomando otros medicamentos, primero debe comprobar con su profesional sanitario que este medicamento es adecuado.,
- Use la dosis más baja que funcione para usted y deténgase tan pronto como pueda.
- Si experimenta cualquier síntoma como mareos, desmayos o palpitaciones cardíacas mientras está tomando domperidona, debe dejar de tomar este medicamento y buscar atención médica. Estos síntomas pueden deberse a un ritmo cardíaco anormal causado por domperidona.
- Medsafe no puede dar consejos sobre la condición médica de una persona. Si tiene alguna duda sobre algún medicamento que esté tomando Medsafe, le recomendamos que hable con su profesional sanitario.,
información para profesionales de la salud
- El balance beneficio-riesgo global de domperidona sigue siendo positivo.
- La dosis máxima recomendada de domperidona se ha reducido de 80 mg al día a 40 mg al día. Utilice la dosis efectiva más baja durante el menor tiempo posible.
- La dosis máxima recomendada en niños que pesan ≤ 35 kg es de 0,25 mg/kg tres a cuatro veces al día hasta 1,0 mg/kg/día. La domperidona está contraindicada en niños menores de 2 años.,
- domperidona se ha relacionado con la prolongación del intervalo QT y, por tanto, está contraindicada con inhibidores potentes del CYP3A4 y con otros medicamentos que prolongan el intervalo QTc.
- domperidona debe utilizarse con precaución en pacientes de edad avanzada o con enfermedad cardíaca actual o previa.
- Los pacientes que reciben tratamiento a largo plazo con domperidona deben ser revisados regularmente para determinar la eficacia, los efectos adversos y el desarrollo de factores de riesgo cardiovascular.,
- Los Factores de riesgo relevantes para eventos cardiovasculares asociados con domperidona incluyen hipertensión, hiperlipidemia, obesidad, diabetes, tabaquismo y consumo excesivo de alcohol.
- domperidona está indicada para los síntomas dispépticos asociados con el retraso en el vaciado gástrico y los síntomas agudos de náuseas y vómitos.
- No hay pruebas suficientes para apoyar el uso de domperidona en la enfermedad por reflujo gastroesofágico infantil y puede no ser adecuada para náuseas y vómitos inducidos por quimioterapia o radioterapia o náuseas y vómitos postoperatorios.,
- También se ha encontrado que otros medicamentos utilizados para tratar trastornos digestivos o náuseas y vómitos causan prolongación del intervalo QTc.
- analice los beneficios y riesgos de los daños del tratamiento con domperidona con los pacientes antes de comenzar el tratamiento. Notifique cualquier reacción adversa al centro de monitorización de reacciones adversas (CARM).
resumen de la revisión
el MARC revisó los últimos datos en junio de 2014. El MARC concluyó que si bien el balance de beneficios y riesgo de daños para la domperidona sigue siendo favorable, existe un pequeño aumento del riesgo de efectos adversos al corazón.,
muchos estudios tuvieron un bajo número de eventos globales y los valores de riesgo variaron entre los diferentes estudios. Por lo tanto, no pudo medirse una estimación real del riesgo. A continuación se presenta un resumen de los datos revisados:
Tabla 1: riesgo de muerte súbita cardiaca: estudio poblacional de casos y Control1.
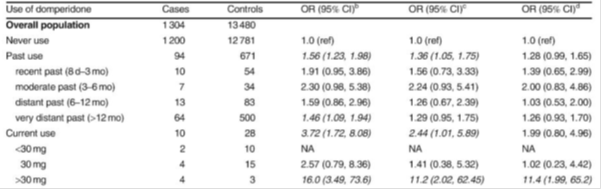
Tabla 2: riesgo de arritmia ventricular grave y muerte súbita cardíaca con domperidona en relación con la ausencia de exposición a los medicamentos del estudio o exposición a inhibidores de la bomba de protones: estudio de casos y control anidado de base poblacional 2.,
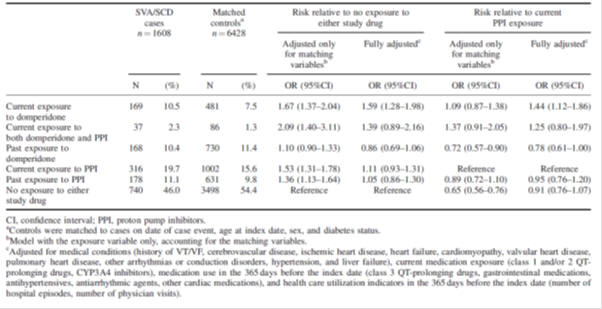
Tabla 3: Evaluación del intervalo QTc antes y durante la administración de domperidona en bebés prematuros (n=40)3
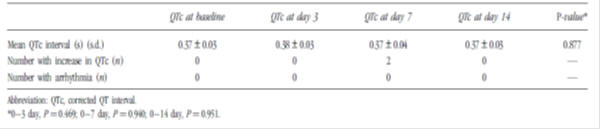
hubo limitaciones en los estudios incluidos en la revisión, como el carácter observacional de la mayoría de los estudios, la falta de información sobre indicación de uso, gravedad de la enfermedad, dosis y régimen, y otros factores de riesgo como tabaquismo, medicamentos concomitantes y comorbilidades. El sesgo protopático es cuando un tratamiento para los primeros síntomas de una enfermedad u otro resultado parece causar el resultado., En esta situación, a los pacientes se les puede haber prescrito domperidona para síntomas gastrointestinales inespecíficos que, de hecho, pueden ser los síntomas prodrómicos de la enfermedad coronaria. Por lo tanto, el sesgo protopático y la confusión por indicación no pueden excluirse en muchos de los estudios observacionales.
Los estudios adicionales revisados incluyeron un estudio de seguridad postautorización, así como estudios que investigaron los efectos del uso de domperidona en el intervalo QTc en adultos., Un estudio exhaustivo del intervalo QT no mostró una respuesta clínicamente relevante dosis-QTc ni una respuesta exposición-QTc con domperidona; sin embargo, los informes de casos de prolongación del intervalo QTc, arritmia y muerte súbita cardíaca con domperidona significan que este riesgo no puede excluirse completamente.
el MARC observó que otros tipos de medicamentos utilizados para tratar trastornos digestivos o náuseas y vómitos también se han asociado con la prolongación del intervalo QT. Estos factores deben tenerse en cuenta al elegir el mejor medicamento para un paciente individual.
- van Noord C, Dieleman JP, van Herpen G, et al. (2010)., Domperidone and Ventricular Arrhythmia or Sudden Cardiac Death: a population-based case-control study in the Netherlands. Drug Safety, 33( 11): 1003-14
- Johannes CB, Varas-Lorenzo C, McQuay LJ, et al. (2010). Riesgo de arritmia ventricular grave y muerte súbita cardíaca en una cohorte de usuarios de domperidona: un estudio de casos y controles anidado. Pharmacoepidemiology and Drug Safety, 19: 881-88
- Gunlemez a, Babaoglu a, Arisoy AE, et al. (2010). Efecto de domperidona sobre el intervalo QTc en niños prematuros. Revista de Perinatología, 30: 50-3
¿qué acciones está tomando Medsafe?,
Medsafe está trabajando con los patrocinadores de estos productos para garantizar que las hojas de datos y la información sobre medicamentos para el consumidor describan adecuadamente la seguridad de domperidona.,Aplicación ADR en línea
los prescriptores pueden enviar utilizando la herramienta de informes en línea disponible en el software de gestión de pacientes
Medsafe no puede dar consejos sobre la condición médica de una persona., Si tiene alguna duda sobre algún medicamento que esté tomando Medsafe, le recomendamos que hable con su profesional sanitario.