la teoría cuántica nos dice que tanto la luz como la materia consisten en pequeñas partículas que tienen propiedades ondulatorias asociadas con ellas. La luz se compone de partículas llamadas fotones, y la materia se compone de partículas llamadas electrones, protones, neutrones. Es solo cuando la masa de una partícula se hace lo suficientemente pequeña que sus propiedades onduladas aparecen.
para ayudar a entender todo esto, veamos cómo se comporta la luz como una onda y como una partícula.,
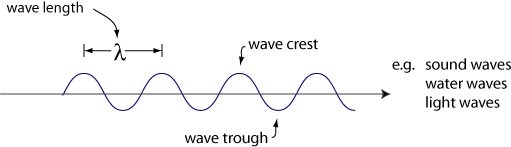
comportamiento ondulatorio de la luz
en la década de 1600 Christiaan Huygens, un físico holandés, demostró que la luz se comporta como una onda.
un comportamiento de las ondas es difracción
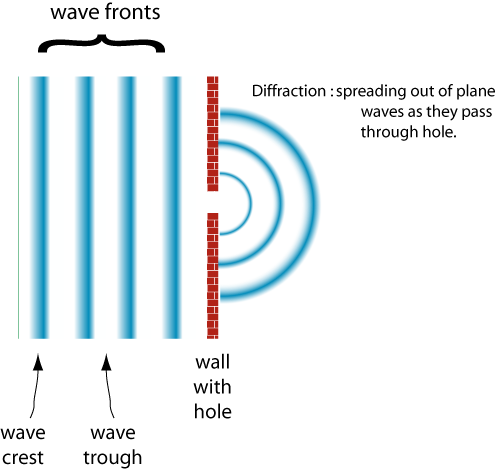
a medida que el ancho de la ranura se vuelve más grande que la longitud de onda, la onda se difracta menos.,
otro comportamiento de las ondas es la interferencia

fue James Clerk Maxwell quien mostró en los años 1800 que la luz es una onda electromagnética que viaja a través del espacio a la velocidad de la luz. La frecuencia de la luz está relacionada con su longitud de onda de acuerdo a

veamos un ejemplo de cálculo.
el resplandor azul claro emitido por las farolas de mercury tiene una longitud de onda de λ = 436nm. ¿Cuál es su frecuencia?,

La unidad s-1 es tan común cuando se habla de ondas que se le dio el nombre de Hertz. Es decir, 1 s-1 = 1 Hz. Por lo tanto, diríamos que la luz con una longitud de onda de 436 nm corresponde a una frecuencia de 6.88 × 1014 Hertz.

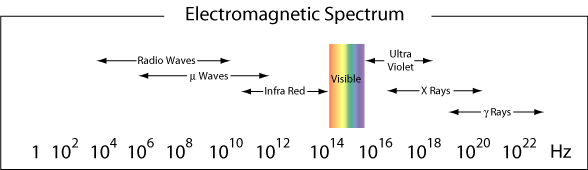
La región de λ ≈ 400-750 nm es visible para el ojo humano y por eso se le llama la región visible de la radiación electromagnética. Como vimos en el ejemplo anterior, la luz azul está cerca del límite de alta frecuencia de nuestros ojos., La luz roja, con longitudes de onda cercanas a 750 nm están en el límite de baja frecuencia de nuestros ojos. La luz que contiene todas las frecuencias en la región visible aparecerá como luz blanca.
más generalmente, las diferentes regiones del espectro electromagnético reciben diferentes nombres. A continuación se presentan los nombres dados a las diferentes regiones (rangos de frecuencia) de luz de acuerdo con su rango de frecuencia.
comportamiento de partículas de la luz
en este punto puede pensar que es bastante obvio que la luz se comporta como una onda., Entonces, ¿por qué sabemos que la luz está realmente compuesta de partículas llamadas fotones? El apoyo a esta idea proviene de un experimento que se llama el efecto fotoeléctrico.

Una característica importante de este experimento es que el electrón se emite desde el metal con una energía cinética específica (es decir, una velocidad específica).
ahora cualquiera que esté familiarizado con el comportamiento de las ondas sabe que la energía asociada con una onda está relacionada con su amplitud o intensidad., Por ejemplo, en el océano cuanto más grande es la ola, mayor es la energía asociada con la ola. ¡No son las pequeñas olas las que te golpean, son las grandes olas! Así que todos los que pensaban que la luz es solo una onda estaban realmente confundidos cuando la intensidad de la luz se incrementó (luz más brillante) y la energía cinética del electrón emitido no cambió. Lo que sucede es que a medida que haces que la luz sea más brillante, se emiten más electrones, pero todos tienen la misma energía cinética.
bueno, pensaron que la energía cinética del electrón emitido debía depender de algo., Así que variaron la frecuencia de la luz y esto cambió la energía cinética del electrón emitido.

Sin embargo, hay una frecuencia crítica para cada metal, ν0, por debajo de la cual no se emiten electrones. Esto nos dice que la energía cinética es igual a la frecuencia de la luz por una constante (es decir, la pendiente de la línea). Esa constante se llama constante de Planck y se le da el símbolo h.
h = 6.63 × 10-34 J · s ← constante de Planck
ahora podemos escribir una ecuación para la energía cinética del electrón emitido.,
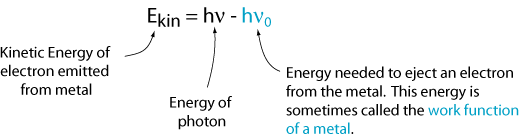
Este resultado no es consistente con la imagen de la luz como una onda. Una explicación que es consistente con esta imagen es que la luz viene en paquetes discretos, llamados fotones, y cada fotón debe tener suficiente energía para expulsar un solo electrón. De lo contrario, no pasa nada. Por lo tanto, la energía de un solo fotón es:
Ephoton = H ν
Cuando esto se entendió por primera vez, fue un resultado muy sorprendente. Fue Albert Einstein quien primero explicó el efecto fotoeléctrico y recibió el Premio Nobel de Física por este trabajo.,
entonces, en resumen-la luz es una partícula con comportamiento ondulatorio.
Homework from Chemisty, the Central Science, 10th Ed.
6.5, 6.8, 6.9, 6.11, 6.13, 6.15, 6.17, 6.19, 6.21, 6.23, 6.25, 6.27, 6.29