La teoria quantistica ci dice che sia la luce che la materia sono costituite da minuscole particelle che hanno proprietà ondulatorie ad esse associate. La luce è composta da particelle chiamate fotoni e la materia è composta da particelle chiamate elettroni, protoni, neutroni. È solo quando la massa di una particella diventa abbastanza piccola che le sue proprietà ondulatorie appaiono.
Per aiutare a capire tutto questo diamo un’occhiata a come la luce si comporta come un’onda e come una particella.,
Comportamento ondulatorio della luce
Nel 1600 Christiaan Huygens, un fisico olandese, mostrò che la luce si comporta come un’onda.
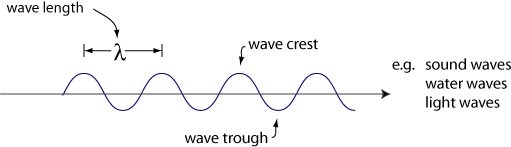
Un comportamento delle onde è la diffrazione
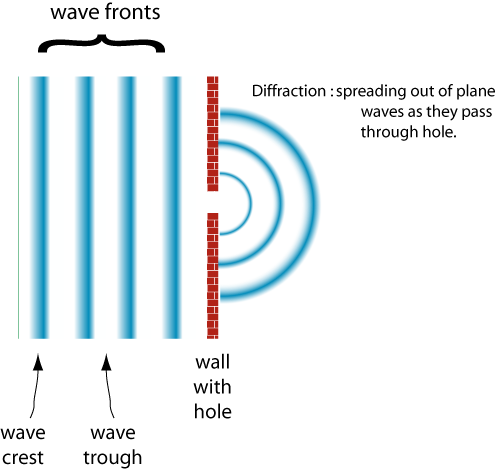
Quando la larghezza della fessura diventa più grande della lunghezza d’onda l’onda viene diffratta di meno.,
Un altro comportamento delle onde è l’interferenza

Fu James Clerk Maxwell a mostrare nel 1800 che la luce è un’onda elettromagnetica che viaggia attraverso lo spazio alla velocità della luce. La frequenza della luce è correlata alla sua lunghezza d’onda secondo

Diamo un’occhiata a un esempio di calcolo.
La luce blu emessa dai lampioni a mercurio ha una lunghezza d’onda di λ = 436nm. Qual è la sua frequenza?,

L’unità s-1 è così comune quando si parla di onde che è stato dato il nome Hertz. Cioè, 1 s-1 = 1 Hz. Quindi, diremmo che la luce con una lunghezza d’onda di 436 nm corrisponde a una frequenza di 6,88 × 1014 Hertz.

La regione da λ ≈ 400-750 nm è visibile all’occhio umano ed è quindi chiamata la regione visibile della radiazione elettromagnetica. Come abbiamo visto nell’esempio sopra, la luce blu è vicino al limite di alta frequenza dei nostri occhi., La luce rossa, con lunghezze d’onda vicine a 750 nm, è al limite di bassa frequenza dei nostri occhi. La luce che contiene tutte le frequenze nella regione visibile apparirà come luce bianca.
Più in generale, alle diverse regioni dello spettro elettromagnetico vengono dati nomi diversi. Di seguito sono riportati i nomi dati alle diverse regioni (intervalli di frequenza) della luce in base alla loro gamma di frequenza.
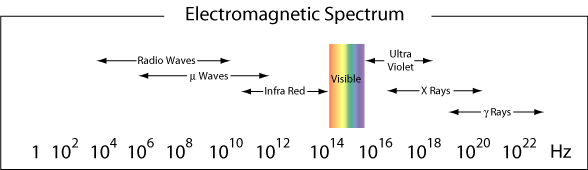
Comportamento particellare della Luce
A questo punto potresti pensare che sia abbastanza ovvio che la luce si comporti come un’onda., Quindi, perché come facciamo a sapere che la luce è davvero composta da particelle chiamate fotoni? Il supporto per questa idea deriva da un esperimento chiamato effetto fotoelettrico.

Una caratteristica importante di questo esperimento è che l’elettrone viene emesso dal metallo con una specifica energia cinetica (cioè una velocità specifica).
Ora chiunque abbia familiarità con il comportamento delle onde sa che l’energia associata a un’onda è correlata alla sua ampiezza o intensità., Ad esempio, nell’oceano più grande è l’onda, maggiore è l’energia associata all’onda. Non sono le piccole onde che ti sbattono sopra sono le grandi onde! Quindi tutti coloro che pensavano che la luce fosse solo un’onda erano davvero confusi quando l’intensità della luce era aumentata (luce più luminosa) e l’energia cinetica dell’elettrone emesso non cambiava. Quello che succede è che quando si rende la luce più luminosa vengono emessi più elettroni ma tutti hanno la stessa energia cinetica.
Beh, pensavano che l’energia cinetica dell’elettrone emesso dovesse dipendere da qualcosa., Quindi hanno variato la frequenza della luce e questo ha cambiato l’energia cinetica dell’elettrone emesso.

Tuttavia, c’è una frequenza critica per ogni metallo, ν0, al di sotto della quale non vengono emessi elettroni. Questo ci dice che l’energia cinetica è uguale alla frequenza della luce per una costante (cioè la pendenza della linea). Questa costante è chiamata Costante di Planck ed è data dal simbolo h.
h = 6,63 × 10-34 J · s ← Costante di Planck
Ora possiamo scrivere un’equazione per l’energia cinetica dell’elettrone emesso.,
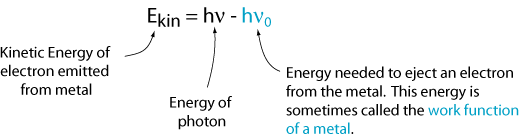
Questo risultato non è coerente con l’immagine della luce come onda. Una spiegazione che è coerente con questa immagine è che la luce arriva in pacchetti discreti, chiamati fotoni, e ogni fotone deve avere abbastanza energia per espellere un singolo elettrone. Altrimenti, non succede nulla. Quindi, l’energia di un singolo fotone è:
Ephoton = h ν
Quando questo è stato capito per la prima volta, è stato un risultato molto sorprendente. È stato Albert Einstein a spiegare per primo ileffetto fotoelettrico e ha ricevuto il premio Nobel per la fisica per questo lavoro.,
Quindi, in sintesi-la luce è una particella con comportamento ondulatorio.
Compiti da Chemisty, The Central Science, 10th Ed.
6.5, 6.8, 6.9, 6.11, 6.13, 6.15, 6.17, 6.19, 6.21, 6.23, 6.25, 6.27, 6.29