Entro la fine della chimica gen, il calcolo degli stati di ossidazione di metalli diversi dovrebbe essere abbastanza familiare. Ecco cosa fai. Prendi un composto tipico – \(FeCl_3\), per esempio. Tratta ogni legame tra il metallo e un atomo diverso come se fosse un legame ionico. Ciò significa che gli elementi più elettronegativi (come il cloro, diciamo o l’ossigeno) portano cariche negative, e l’elemento meno elettronegativo (come il metallo) porta la carica positiva.,
Se il composto è neutro, anche la somma degli stati di ossidazione deve essere neutra. (Se il composto ha una carica, si regolano gli stati di ossidazione di conseguenza in modo che la loro somma sia uguale alla carica).

Ora ecco un divertente esercizio. Prova ad applicare le stesse regole al carbonio. Ti sembrerà un po ‘ strano. Perché? Perché ci sono due differenze chiave:
- In primo luogo, il carbonio è spesso più elettronegativo (2.5) di alcuni degli atomi a cui è legato (come H, 2.2)., Quindi cosa fai in questo caso?
- In secondo luogo, a differenza dei legami metallo-metallo, i legami carbonio-carbonio sono onnipresenti. Così come si fa a trattare con loro?
Due risposte.
- In un legame C-H, l’H viene trattato come se avesse uno stato di ossidazione di +1. Ciò significa che ogni legame CH diminuirà lo stato di ossidazione del carbonio di 1.
- Due legami tra lo stesso atomo non influenzano lo stato di ossidazione (ricordiamo che lo stato di ossidazione di Cl in Cl-Cl (e quello di H in H-H) è zero. Quindi un carbonio collegato a 4 carboni ha uno stato di ossidazione pari a zero.,
Quindi, a differenza dei metalli, che sono quasi sempre in uno stato di ossidazione positivo, lo stato di ossidazione del carbonio può variare ampiamente, da -4 (in CH4) a +4 (come in CO2). Ecco alcuni esempi.
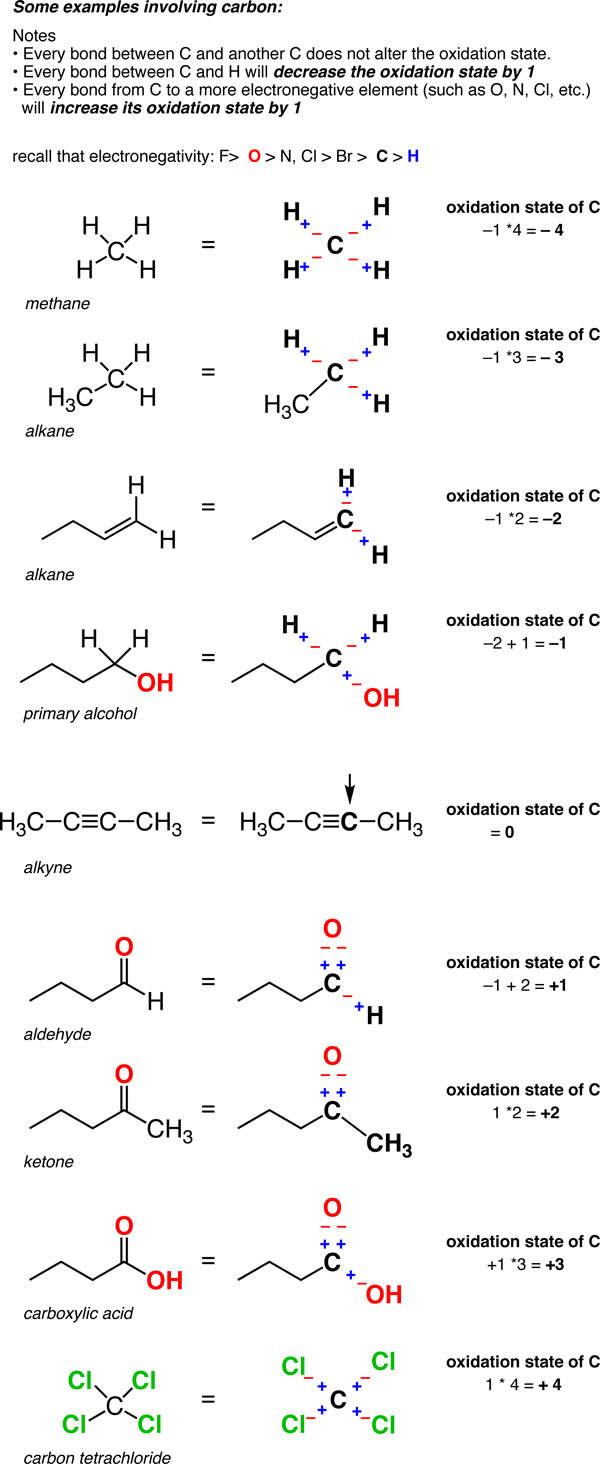
(Non dimenticare che questo è chiamato “formalismo” per un motivo. La carica sul carbonio non è davvero +4 o -4. Ma il formalismo dello stato di ossidazione ci aiuta a tenere traccia di dove stanno andando gli elettroni, che tornerà utile molto presto).,
Con una comprensione di come calcolare gli stati di ossidazione sul carbonio, siamo pronti per il passo successivo: comprendere i cambiamenti nello stato di ossidazione al carbonio, attraverso reazioni note come ossidazioni (dove lo stato di ossidazione è aumentato) e riduzioni (dove lo stato di ossidazione è ridotto). Ne riparleremo la prossima volta.