Disolfuro di carbonio Proprietà chimiche, usi, produzione
Usi
Produzione di fibre di viscosa di rayon e film di cellophane; solvente per lipidi, zolfo, gomma, fosforo, oli, resine e cere; insetticida.
Proprietà chimiche
Il disolfuro di carbonio (bisolfuro di carbonio; CS2; CASRN 75-15-0), nella sua forma pura è un liquido incolore che evapora facilmente a temperatura ambiente, con un odore aromatico dolce simile a quello del cloroformio., Nella sua forma commerciale e reagente impura, tuttavia, il disolfuro di carbonio è un liquido giallastro con un odore maleodorante. Può essere rilevato dall’odore a circa 1 ppm, ma il senso dell’olfatto si affatica rapidamente e, quindi, l’odore non serve come una buona proprietà di avvertimento. Ha una pressione di vapore di 297mmHg e solubilità in acqua in peso di 0,3% a 20 ° C (68 °F). Una volta che il disolfuro di carbonio è nell’aria, si scompone in sostanze più semplici entro pochi giorni dal rilascio (OEHHA, 2001).,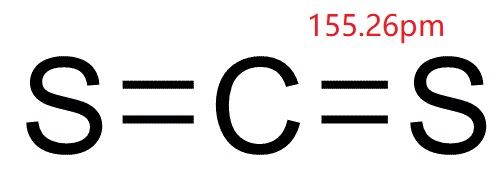
Proprietà fisiche
Chiaro, incolore a liquido giallo pallido; odore etereo quando puro. I gradi tecnici hanno un odore forte, fallo,marcio, simile al ravanello. Leonardos et al. (1969) ha riportato una soglia di odore nell’aria di 210 ppbv.
Usi
Il disolfuro di carbonio viene utilizzato nella produzione di rayon di cellulosa rigenerata, cellophane, disinfettanti del suolo e tubi a vuoto elettronici. Altri usi principali sono nella produzione di tetracloruro di carbonio, xantati, tiocianati, adesivi per compensato e accessori in gomma., Inoltre è usato come solvente e come eluante di asan per i prodotti organici adsorbiti sull’analisi dell’aria di charcoalin.
Usi
Il disolfuro di carbonio è usato come materia prima nella produzione di cose come rayon, cellophane, semiconduttori e tetracloruro di carbonio e per produrre alcuni pesticidi. Viene utilizzato come solvente industriale e intermedio chimico per sciogliere la gomma per produrre pneumatici (ATSDR, 1996), nonché nella fumigazione dei cereali, nella ricerca di chimica analitica, nello sgrassaggio, nel lavaggio a secco e nell’estrazione dell’olio (Finkel et al., 1983)., Le fonti naturali di disolfuro di carbonio includono l’oceano aperto, le aree costiere ad alta attività biologica, la riduzione microbica dei solfati nel suolo, le paludi e alcune piante superiori in cui la fonte di disolfuro di carbonio sono le radici degli alberi (Carroll, 1985; Khalil e Rasmussen, 1984).
In precedenza, il disolfuro di carbonio veniva usato come pesticida, dove veniva tipicamente miscelato con tetracloruro di carbonio in una miscela 20/80, rispettivamente. Questa miscela è stata utilizzata per sterminare insetti e roditori da interi boxcars di grano, mais, segale e altri cereali (Peters et al., 1988)., I fumigatori del grano possono essere intossicati acutamente e possono essere cronicamente esposti al disolfuro di carbonio. Pertanto, alla fine degli anni 1980, tutti i pesticidi contenenti disolfuro di carbonio come principio attivo sono stati cancellati dall’Agenzia per la protezione ambientale degli Stati Uniti (U. S. EPA) (U. S. EPA, 1999).
Utilizza
Nella produzione di rayon, tetracloruro di carbonio, xantogenati, disinfettanti del suolo, tubi a vuoto elettronici. Solvente per fosforo, zolfo, selenio, bromo, iodio, grassi, resine, gomme.,
Preparazione
Il disolfuro di carbonio è prodotto riscaldando il vapore di zolfo con carbone e condensando i vapori del composto formato. In alternativa, può essere ottenuto riscaldando lo zolfo con gas naturale o frazioni di petrolio. Invece di zolfo, può essere usato H2S. La reazione avviene a temperature molto elevate. Il prodotto ottenuto in queste reazioni può contenere impurità di zolfo. Il disolfuro di carbonio viene purificato per distillazione.,
Descrizione generale
Il disolfuro di carbonio puro è un liquido incolore dall’odore gradevole simile a quello del cloroformio, mentre il disolfuro di carbonio impuro è un liquido giallastro dall’odore sgradevole, simile a quello dei ravanelli in decomposizione. L’esposizione al disolfuro di carbonio si verifica nei luoghi di lavoro industriali. Le industrie associate agli impianti di gassificazione del carbone rilasciano più disolfuro di carbonio, solfuro di carbonile e idrogeno solforato. Il disolfuro di carbonio viene utilizzato in grandi quantità come prodotto chimico industriale per la produzione di fibre di rayon viscosa., Infatti, la principale fonte di inquinamento ambientale sia interno che esterno da disolfuro di carbonio è causata dalle emissioni rilasciate nell’aria dagli impianti di viscosa.
Aria& Reazioni dell’acqua
Facilmente infiammabile. Insolubile in acqua.
Profilo di reattività
Il disolfuro di carbonio ha una temperatura di autoaccensione estremamente bassa (125°C). Può accendersi o addirittura esplodere quando riscaldato. È noto che il vapore o il liquido si accendono a contatto con i tubi del vapore, in particolare se arrugginiti . Pericolo di esplosione se esposto a fiamme, calore, scintille o attrito., Miscele con tetraossido di litio, sodio, potassio o dinitrogeno possono esplodere quando scioccato. Reazione potenzialmente esplosiva con ossido di azoto, cloro, acido permanganico (forti agenti ossidanti). Il vapore si accende a contatto con polvere di alluminio o fluoro. Reagisce violentemente con azidi, etilammina etilendiammina, etilene immina. Emette fumi altamente tossici di ossidi di zolfo quando riscaldati alla decomposizione . L’ammide di sodio forma gas H2S tossici e infiammabili con CS2. (714)
Pericolo
Un veleno. Tossico per assorbimento cutaneo. Rischio di incendio e esplosione altamente infiammabile, pericoloso, può essere acceso per attrito., Limiti di esplosività nell’aria1-50%. Cancerogeno discutibile. Compromissione del sistema periferico.
Pericolo per la salute
Sebbene il disolfuro di carbonio mostri una bassa tossicità nella maggior parte degli animali da esperimento, la sua tossicità è relativamente maggiore negli esseri umani. La via primaria di esposizione è l’inalazione di vapori. Può anche entrare nel corpo attraversoassorbimento della pelle. L’effetto tossico della singola esposizione è la narcosi. L’esposizione ripetuta causa mal di testa, vertigini, affaticamento, nervosismo, insonnia, psicosi, irritazione, tremori,perdita di appetito, indigestione e disturbi gastrici., I sintomi di cui sopra possono manifestarsi nell’uomo dopo alcuni mesi di esposizione giornaliera di 4 ore a 150 ppm. Una concentrazione inferiore a 30 ppm non produce alcunieffetti tossici notabili. Un’esposizione di 15 minuti a 5000 ppm di disolfuro di carbonio nell’aria può essere fatale per l’uomo. Ingestione di 5-10 ml di illiquido può essere fatale. Il valore orale di LD50 inrats è nell’intervallo 3000 mg / kg.Chapman et al. (1991) ha riportato tremore delle dita nell’uomo simile alla malattia di Parkinson idiopatica derivante dall’esposizione cronicaa pesticidi a base di disolfuro di carbonio., Gli effetti similarneurotossici del disulfiram del pesticida sono stati precedentemente attribuiti al suo metabolita,CS2 (Rainey Jr.1977). Sills et al. (2005) sono stati condotti studi di inalazione di neurotossicità di CS2 sui principali organi spinali del sistema nervoso centrale e delle porzioni distali di lunghi assoni mielinizzati del sistema nervoso periferico in ratti F344. Gli autori hanno osservatoche CS2 ha prodotto cross-linking intra e intermolecolare delle proteine in vivo. Tale covalentcross-linking nelle proteine del neurofilamento priorto l’insorgenza di lesioni ha contribuito ai gonfiori assonali neu-rofilamentosi.Chou et al., (2005) hanno studiato la tossicità cutanea indotta da CS2 nei topi e le alterazioni della permeabilità epidermica che portano a cambiamenti fisiologici e patologici dall’esposizione topica a CS2. Gli autori hanno postulato due percorsi meccanicistici per tenere conto delle alterazioni epidermiche indotte da CS2, uno che coinvolge l’esaurimento lipidico intercellulare e l’altro con danno cheratinocitario.
Pericolo di incendio
Temperatura di accensione pericolosamente bassa: 212F. I vapori possono essere accesi dal contatto con la lampadina ordinaria, quando riscaldata alla decomposizione, il disolfuro di carbonio emette fumi altamente tossici di ossidi di zolfo., Quando riscaldato alla decomposizione, emette fumi altamente tossici di ossidi di zolfo e può reagire vigorosamente con materiali ossidanti. Evitare aria, ruggine, alogeni, azoturi metallici, metalli, ossidanti; se esposti al calore o alla fiamma reagisce violentemente con alluminio, cloro, azoturi, ipoclorito, etilammina diammina, etilene immina, fluoro, azoturi metallici di litio, potassio, cesio, rubidio e sodio, ossidi di azoto, potassio, zinco e (acido solforico più permanganato). Si decompone in piedi per molto tempo.,
Infiammabilità ed esplosibilità
Il disolfuro di carbonio è estremamente infiammabile ed è un pericoloso pericolo di incendio (NFPArating = 3). È ha un’alta pressione di vapore ed estremamente bassa temperatura di autoignitiontemperature. Il suo vapore è più pesante dell’aria e può percorrere una distanza considerevole da asource di accensione e flash back. Il vapore forma miscele esplosive in aria atconcentrations di 1,3 a 50%. Il disolfuro di carbonio può essere acceso da superfici calde come bagni di vapore che normalmente non costituirebbero una fonte di accensione per altri vapori infiammabili., Ruggine (ossido di ferro) può aumentare la probabilità di accensione da caldosuperfici. Gli incendi di disolfuro di carbonio dovrebbero essere estinti con CO2 o sostanze chimiche asciutteestinguenti.
Profilo di sicurezza
Un veleno umano per via non specificata. Leggermente tossico per l’uomo per inalazione. Un veleno sperimentale per via intraperitoneale. Effetti riproduttivi umani sulla spermatogenesi per inalazione. Effetti teratogeni e riproduttivi sperimentali. Dati sulla mutazione umana riportati., Il principale effetto tossico è sul sistema nervoso centrale, che agisce come narcotico e anestetico nell’avvelenamento acuto con morte a seguito di insufficienza respiratoria. Nell’avvelenamento cronico, l’effetto sul sistema nervoso è uno dei danni centrali e periferici, che può essere permanente se il danno è stato grave. Liquido infiammabile. Un pericoloso pericolo di incendio quando esposto a calore, fiamme, scintille, attrito o materiali ossidanti. Grave pericolo di esplosione se esposto al calore o alla fiamma. Accensione e reazione potenzialmente esplosiva quando riscaldato a contatto con ruggine o ferro., Mixtures with sodium or potassiumsodum alloys are powerful, shock-sensitive explosives. Explodes on contact with permanganic acid. Potentially explosive reaction with nitrogen oxide, chlorine (catalyzed by iron). Mixtures with dinitrogen tetraoxide are heat-, spark-, and shocksensitive explosives. Reacts with metal azides to produce shockand heat-sensitive, explosive metal azidodtthioformates. Aluminum powder ignites in CS2 vapor. The vapor ignites on contact with fluorine., Reagisce violentemente con azidi, CsN3, Cl0, etilammina diammina, etilene immina, Pb (N3)2, LiN3, (H2so4 + permanganati), KN3, RbN3, NaN3, fenilcoppertrifenilfosfina complessi. Incompatibile con aria, metalli, ossidanti. Per combattere il fuoco, utilizzare acqua, CO2, chimica secca, nebbia, nebbia. Quando riscaldato alla decomposizione emette fumi altamente tossici di SO,.,
il Potenziale di Esposizione
disolfuro di Carbonio è utilizzato nella produzione di rayon viscosa; sali di ammonio; tetracloruro di carbonio; carbanilide, xantho genates; flottazione agenti; soildisinfectants; coloranti; tubi elettronici a vuoto; vetro ottico;vernici, smalti, sverniciatori; vernici; vernici smacchiatori; sego, prodotti tessili, di esplosivi; combustibile per razzi; mastici; conservanti, e il cemento di gomma; come solvente per il fosforo,zolfo, selenio, bromo, iodio; alcali cellulosa; grassi,cere, lacche, canfora, resine a freddo in gomma vulcanizzata., Viene anche utilizzato nello sgrassaggio; analisi chimica; elettrodeposizione; fumigazione del grano; estrazione dell’olio; e pulizia a secco. È ampiamente usato come intermedio di pesticidi.
Fonte
Identificato tra 139 composti volatili identificati nel melone (Cucumis melo var.reticola cv. Sol Real) utilizzando un metodo di microestrazione in fase solida rapid headspace automatizzato (Beaulieu e Grimm, 2001).
Destino ambientale
Chimico / fisico. Il disolfuro di carbonio idrolizza in soluzioni alcaline al disolfuro di carbonio e idrogeno (Peyton et al., 1976).,
In una soluzione alcalina acquosa contenente perossido di idrogeno, ditiopercarbonato, solfuro, zolfo elementare e polisolfuri possono essere attesi per formare (Elliott, 1990). In una soluzione alcalina acquosa (pH ≥8), disolfuro di carbonioha reagito con perossido di idrogeno formando ioni solfato e carbonato. Tuttavia, quando il pH viene abbassato a 7-7, 4, si forma lo zolfo colloidale (Adewuyi e Carmichael, 1987).
Una soluzione acquosa contenente disolfuro di carbonio reagisce con ipoclorito di sodio formando biossido di carbonio, acido solforico e cloruro di sodio (Patnaik, 1992)., Forma un emiidratoche si decompone a -3°C (Keith e Walters, 1992).Fumigante agricoloBruci con una fiamma blu che rilascia anidride carbonica e anidride solforosa (Windholz et al.,1983). Emette ossidi di zolfo molto tossici quando riscaldati alla decomposizione (Lewis, 1990).Il disolfuro di carbonio si ossida nella troposfera producendo solfuro di carbonile. L’emivita atmosferica per il disolfuro di carbonio e il solfuro di carbonile sono stati stimati in circa 2 anni e 13 giorni, rispettivamente (Khalil e Rasmussen, 1984).,
stoccaggio
il carbondisolfuro deve essere utilizzato solo in aree prive di fonti di accensione (comprese piastre riscaldanti,lampadine a incandescenza e bagni di vapore) e questa sostanza deve essere conservata in contenitori metallici strettamente sigillati in aree separate dagli ossidanti.
Spedizione
UN1131 Disolfuro di carbonio, classe di pericolo: 3; Etichette: 3-Liquido infiammabile, 6.1-Materiali velenosi.,
Metodi di purificazione
Agitare per 3 ore con tre porzioni di soluzione KMnO4 (5g / L), due volte per 6 ore con mercurio (per rimuovere le impurità di solfuro) fino a quando non si verifica un ulteriore oscuramento dell’interfaccia e infine con una soluzione di HgSO4 (2,5 g/L) o HgCl2 freddo e saturo. Asciugare con CaCl2, MgSO4 o CaH2 (con ulteriore essiccazione mediante riflusso su P2O5), seguita da distillazione frazionata in luce diffusa. I metalli alcalini non possono essere utilizzati come agenti essiccanti. È stato anche purificato stando in piedi con bromo (0.,5mL / L) per 3-4hours, scuotendo rapidamente con la soluzione di KOH, poi i giri di rame (per rimuovere il bromo non reagito) ed asciugando con CaCl2. CS2 è altamente TOSSICO e facilmente INFIAMMABILE. Lavora in una buona fumosità. Piccole quantità di CS2 sono state purificate (compresa la rimozione di idrocarburi) mediante agitazione meccanica di un campione di 45-50g con una soluzione di 130g di solfuro di sodio in 150mL di H2O per 24 ore a 35-40o. La soluzione acquosa di sodio tiocarbonato viene separata da CS2 non reagita, quindi precipitata con 140g di solfato di rame in 350g di acqua, con raffreddamento., Dopo aver filtrato il tiocarbonato di rame, viene decomposto passando vapore in esso. Il distillato è separato da H2O e distillato da P2O5.
Incompatibilità
Incompatibile con ossidanti (clorati, nitrati, perossidi, permanganati, perclorati,cloro, bromo, fluoro, ecc.); il contatto può causare incendi o esplosioni. Tenere lontano da materiali alcalini, basi forti, acidi forti, ossoacidi, epossidi. Anche incompatibile conmetalli chimicamente attivi (come sodio, potassio, zinco),azidi, ammine organiche, alogeni. Può decomporsi in modo esplosivo su urti, attrito o commozione cerebrale., Può esplodere onheating. La sostanza può infiammarsi spontaneamente a contatto con l’aria e a contatto con superfici calde, producendo fumi tossici di anidride solforosa. Reagisce violentemente con gli ossidanti per produrre ossidi di zolfo e monossido di carbonio e causare rischi di incendio ed esplosione. Attacca alcune forme di plastica, gomma e rivestimento.
Smaltimento dei rifiuti
Questo composto è un liquido molto infiammabile che evapora rapidamente. Brucia con un Blueflame di anidride carbonica (innocuo) e anidride solforosa.L’anidride solforosa ha un forte odore soffocante; 1000 ppm inair è letale per i ratti., Il liquido puro presenta un fuoco acuto e pericolo di esplosione. Si consiglia la seguente procedura di smaltimento: tutte le apparecchiature o le superfici di contatto devono essere interrate per evitare l’accensione di cariche statiche. Assorbire su vermiculite, sabbia o cenere e coprire con acqua. Trasferireacqua sotterranea in secchi in un’area aperta. Accendi da lontanocon un sentiero excelsior. Se la quantità è elevata, il disolfuro di carboniopuò essere recuperato per distillazione e riconfezionato per l’uso.
Precauzioni
Durante la manipolazione di disulfi di carbonio, i lavoratori professionali richiedono abbigliamento adeguato, protezione degli occhi e protezione delle vie respiratorie., I lavoratori dovrebbero usare la sostanza chimica sotto la gestione addestrata. A contatto con gli occhi, sciacquare immediatamente con grandi quantità d’acqua. A contatto con la pelle, il lavoratore deve rimuovere rapidamente gli indumenti contaminati e richiedere immediatamente assistenza medica