Panoramica
L’ossidazione degli acidi grassi β è un processo multistep mediante il quale gli acidi grassi vengono suddivisi da vari tessuti per produrre energia. Gli acidi grassi entrano principalmente in una cellula tramite trasportatori di proteine di acidi grassi sulla superficie cellulare . I trasportatori degli acidi grassi includono la traslocasi degli acidi grassi (FAT / CD36), le proteine di trasporto degli acidi grassi specifiche del tessuto (FATP) e la proteina legante degli acidi grassi legati alla membrana plasmatica (FABPpm). Una volta all’interno della cellula, un gruppo di CoA viene aggiunto all’acido grasso da acil-CoA sintasi grassa (FACS), formando acil-CoA a catena lunga., Carnitina palmitoiltransferasi 1 (CPT1) la conversione dell’acil-CoA a catena lunga in acilcarnitina a catena lunga consente al gruppo di acidi grassi di essere trasportato attraverso la membrana mitocondriale interna tramite la translocasi della carnitina (CAT), che scambia le acilcarnitine a catena lunga con la carnitina. Una membrana mitocondriale interna CPT2 converte quindi l’acilcarnitina a catena lunga in acil-CoA a catena lunga. L’acil-CoA a catena lunga entra nella via β-ossidazione degli acidi grassi, che si traduce nella produzione di un acetil-CoA da ciascun ciclo di β-ossidazione degli acidi grassi., Questo acetil-CoA entra quindi nel ciclo dell’acido tricarbossilico mitocondriale (TCA). Il NADH e il FADH2 prodotti sia dalla β-ossidazione degli acidi grassi che dal ciclo TCA sono utilizzati dalla catena di trasporto degli elettroni per produrre ATP. Una panoramica dell’ossidazione degli acidi grassi è fornita nella Figura 1.

Figura 1. Ossidazione degli acidi grassi Panoramica
L’ossidazione degli acidi grassi β è il processo mediante il quale gli acidi grassi vengono scomposti per produrre energia. Gli acidi grassi entrano principalmente in una cellula tramite trasportatori di proteine di acidi grassi sulla superficie cellulare., Una volta dentro, FACS aggiunge un gruppo del CoA all’acido grasso. CPT1 converte quindi l’acil-CoA a catena lunga in acilcarnitina a catena lunga. La frazione di acidi grassi viene trasportata dal GATTO attraverso la membrana mitocondriale interna. CPT2 converte quindi l’acilcarnitina a catena lunga in acil-CoA a catena lunga. L’acil-CoA a catena lunga può quindi entrare nella via di β-ossidazione degli acidi grassi, con conseguente produzione di un acetil-CoA da ciascun ciclo di β-ossidazione. Questo acetil-CoA entra quindi nel ciclo TCA., Il NADH e il FADH2 prodotti sia dalla β-ossidazione che dal ciclo TCA sono utilizzati dalla catena di trasporto degli elettroni per produrre ATP.
il Ruolo degli acidi Grassi Approvvigionamento Regolare di acidi Grassi β-Ossidazione
Cellulare il trasporto degli acidi grassi:
C’è stato un notevole sforzo in questi ultimi anni per spiegare i meccanismi con cui gli acidi grassi vengono assorbiti dalle cellule, in particolare per determinare se gli acidi grassi vengono trasportati attraverso la membrana cellulare per semplice diffusione o se il trasporto è facilitato da una membrana proteine associate., Mentre vari risultati supportano entrambi i metodi di trasporto, si ritiene che il trasporto da parte delle proteine associate alla membrana sia il mezzo predominante per l’assorbimento di acidi grassi nelle cellule . Sono state identificate varie proteine di membrana che facilitano l’assorbimento cellulare di acidi grassi. I trasportatori di acidi grassi associati alla membrana CD36 / FAT, FABPpm e FATPs differiscono nel loro peso molecolare e grado di modifica post-traslazionale . Stremmel et al. riferito che gli anticorpi diretti contro il fegato di ratto FABPpm inibiscono l’assorbimento di acidi grassi da parte di epatociti, adipociti e cardiomiociti del 50-75%., Questo risultato ha suggerito che una parte significativa dell’assorbimento di acidi grassi dipende dal trasporto mediato dalle proteine in diversi tipi di cellule .
Schaffer e Lodish hanno scoperto FATP usando una strategia di clonazione delle espressioni negli adipociti . L’espressione di questa proteina integrale della membrana di 63 kDa in una linea stabile delle cellule del fibroblasto ha provocato un aumento di 3-4 volte nel trasporto a catena lunga dell’acido grasso. L’identificazione di questo primo FATP ha portato alla scoperta di diverse altre isoforme di FATP (FATP1-6) . FATP1 è espresso prevalentemente nel cuore e nei muscoli scheletrici ., FATP2 e FATP5 sono espressi principalmente nel fegato, dove sono coinvolti nel metabolismo lipidico epatico in associazione con acil-CoA sintetasi. FATP4 è essenziale per l’assorbimento dei lipidi alimentari e ha un ruolo critico nella normale struttura e funzione della pelle. Ad oggi, FATP3 e FATP6 hanno dimostrato di avere poca o nessuna funzione di trasporto di acidi grassi .
Il ruolo della proteina di membrana CD36/GRASSO nell’assorbimento degli acidi grassi e nella β-ossidazione nei mammiferi è stato ampiamente studiato., CD36 / FAT è una proteina di membrana traslocasi di acidi grassi 88 kDa espressa in proporzione al tasso di ossidazione degli acidi grassi nel tessuto muscolare (ad esempio, è espressa più nel cuore che nel muscolo scheletrico) . CD36 / FAT è coinvolto nell’angiogenesi e nell’infiammazione, così come nel metabolismo dei lipidi. La trasfezione di fibroblasti con CD36 / GRASSO ha determinato un aumento dei tassi di assorbimento degli acidi grassi . A differenza di FATP, CD36 / FAT ha la capacità di traslocare tra gli endosomi intracellulari e la membrana plasmatica delle cellule, che consente a CD36/FAT di svolgere un ruolo critico nella regolazione dell’assorbimento degli acidi grassi., L’insulina e la contrazione muscolare possono stimolare la traslocazione CD36/GRASSO dalle riserve intracellulari alla membrana plasmatica, che porta ad una maggiore assorbimento e β-ossidazione degli acidi grassi. L’attivazione di FoxO1 può condurre alla traslocazione CD36/FAT che provoca l’aumento della β-ossidazione degli acidi grassi insieme all’accumulo di triacilglicerolo . Ciò suggerisce un ruolo significativo della segnalazione intracellulare nella funzione CD36 / FAT.
Il meccanismo esatto che induce la traslocazione CD36/FAT è ancora sconosciuto., Tuttavia, si presume che l’attivazione della chinasi proteica attivata da AMP (AMPK) e lo stato energetico delle cellule muscolari possano partecipare alla risposta di traslocazione CD36/GRASSO . Inoltre, la stimolazione della protein chinasi C (PKC) nei cardiomiociti induce la traslocazione CD36/GRASSO, indicando un possibile ruolo del calcio nel processo di traslocazione . D’altra parte, l’inibizione della chinasi del recettore di segnalazione extracellulare (ERK) può bloccare la contrazione muscolare indotta dalla traslocazione CD36/GRASSO ., La modifica post-traslazionale di CD36 / GRASSO attraverso l’ubiquitinazione può anche regolare i livelli proteici intracellulari di CD36 / GRASSO mirando alla proteina per la degradazione. Pertanto, l’insulina aumenta la disponibilità di CD36 / GRASSO per la traslocazione mediante inibizione dell’ubiquitinazione. Tuttavia, gli acidi grassi promuovono l’ubiquitinazione, che porta alla degradazione CD36/GRASSO .
Esterificazione degli acidi grassi in acil-CoA:
Un acido grasso deve essere convertito in acil-CoA grasso per poter entrare nei mitocondri ed essere ossidato ., L’enzima responsabile dell’esterificazione degli acidi grassi in acil-CoA grasso a catena lunga è FACS. Per questa reazione, FACS consuma l’equivalente di due ATP. Un altro enzima, la tioesterasi citosolica (CTE), può rimuovere il CoA convertendo l’acil-CoA grasso in un acido grasso. L’acil-CoA grasso può essere convertito in acil carnitina, permettendogli di essere trasportato nei mitocondri e di entrare nella β-ossidazione degli acidi grassi o di essere convertito in metaboliti lipidici (triacilglicerolo, diacilglicerolo, ceramide, ecc.).,
L’acetil-CoA carbossilasi, malonil-CoA decarbossilasi, malonil-CoA asse:
L’acetil-CoA carbossilasi (ACC) è un enzima centrale coinvolto nella β-ossidazione degli acidi grassi e nella biosintesi degli acidi grassi. ACC catalizza la carbossilazione di acetil-CoA producendo malonil-CoA, che può essere utilizzato dalla sintasi degli acidi grassi per la biosintesi degli acidi grassi . Mentre il malonil-CoA è usato come substrato per la biosintesi degli acidi grassi, il malonil-CoA è anche un potente inibitore dell’assorbimento degli acidi grassi mitocondriali secondario all’inibizione del CPT1 (Figura 2) ., Esistono due forme di ACC, un’isoforma ACC1 da 265 kDa, che è altamente espressa nel fegato e nel tessuto adiposo, e un’isoforma ACC2 da 280 kDa, che è più specifica per gli organi altamente metabolici come il muscolo scheletrico e il cuore . AMPK svolge un ruolo importante nella regolazione ACC1 e ACC2 fosforilando e inibendo l’attività ACC. In situazioni di maggiore domanda di energia, AMPK viene attivato, dove poi fosforila e inattiva entrambe le isoforme di ACC (Figura 3). L’inibizione di ACC2 può portare ad un aumento della β-ossidazione degli acidi grassi, mentre la biosintesi degli acidi grassi diminuisce quando ACC1 è inibito .,

Figura 2. La via β-ossidazione degli acidi grassi
I quattro enzimi principali coinvolti nella β-ossidazione sono: acil-CoA deidrogenasi, enoil-CoA idratasi, idrossi acil-CoA deidrogenasi e chetoacil-CoA tiolasi. L’acil-CoA deidrogenasi crea un doppio legame tra il secondo e il terzo carbonio verso il basso dal gruppo CoA su acil-CoA e nel processo produce un FADH2., Successivamente, l’idratasi enoil-CoA rimuove il doppio legame appena formato, nel processo di aggiunta di un gruppo idrossile al terzo carbonio verso il basso dal gruppo CoA e un idrogeno sul secondo carbonio verso il basso dal gruppo CoA. L’idrossiacil-CoA deidrogenasi rimuove l’idrogeno nel gruppo idrossile appena attaccato e nel processo produce un NADH. Nella fase finale, chetoacil-CoA tiolasi attribuisce un gruppo CoA al terzo carbonio verso il basso dal gruppo CoA con conseguente formazione di due molecole, un acetil-CoA e un acil-CoA che è due carboni più brevi.,
La regolazione a lungo termine dell’ACC dipende dalla regolazione della sua espressione genica. Diversi fattori trascrizionali possono regolare l’espressione genica ACC, tra cui sterol regulatory element binding protein (SREBP1a e SREBP1c) e carboidrati response element binding protein (ChREBP) . SREBP è regolata da insulina, che promuove il reticolo endoplasmatico SREBP1c da scindere e traslocare al nucleo, portando alla stimolazione dell’espressione ACC., Inoltre, i fattori di trascrizione perossisoma proliferator attivato recettore γ coactivator 1 (PGC-1) α e β in grado di stimolare l’espressione di SREBP1a e SREBP1c, entrambi i quali hanno un ruolo vitale nella lipogenesi. L’espressione di ChREBP può essere indotta da alte concentrazioni di glucosio, con conseguente ChREBP attivato che promuove l’espressione di ACC1 e sintasi dell’acido grasso . Il fattore respiratorio nucleare-1 (NRF-1) è un modulatore principale dell’espressione della proteina mitocondriale e della biogenesi mitocondriale, entrambi importanti per una maggiore capacità di β-ossidazione degli acidi grassi mitocondriali ., Ad esempio, Adam et al. ha mostrato che la sovraespressione NRF-1 provoca l’inibizione dell’attività del promotore del gene ACC2 nel cuore dei mammiferi, che migliora i tassi di β-ossidazione degli acidi grassi mitocondriali, promuovendo così la capacità energetica intracellulare complessiva .
La malonil-CoA decarbossilasi (MCD) è l’enzima responsabile della decarbossilazione del malonil-CoA in acetil-CoA . Generalmente, il livello di malonyl-CoA è diminuito quando l’attività di MCD è aumentata, con conseguente tasso elevato di ossidazione dell’acido grasso., È stato riferito che le chinasi proteiche che fosforilano ed inibiscono ACC potrebbero attivare MCD . Tuttavia, l’MCD sembra essere principalmente regolato da mezzi trascrizionali (discussi in seguito). Pertanto, MCD e ACC sembrano lavorare in armonia per regolare il pool di malonyl-CoA che può inibire CPT1 .
Carnitina mitocondriale palmitoil transferasi (CPT):
L’isoforma CPT, CPT1, risiede sulla superficie interna della membrana mitocondriale esterna ed è un importante sito di regolazione dell’assorbimento degli acidi grassi mitocondriali ., Come accennato, CPT1 è potentemente inibito da malonyl-CoA, il prodotto di ACC che si lega al lato citosolico di CPT1. I mammiferi esprimono tre isoforme di CPT1, che sono codificate da diversi geni. L’isoforma epatica (CPT1a), l’isoforma muscolare (CPT1ß) e una terza isoforma di CPT1 (CPT1c), che è espressa principalmente nel cervello e nel testicolo . Più specificamente, il cuore esprime due isoforme di CPT1, un’isoforma di 82 kDa (CPT1a) e l’isoforma predominante di 88 kDa (CPT1ß) (che ha la più alta sensibilità all’inibizione del malonil-CoA)., L’insulina e l’ormone tiroideo possono regolare la sensibilità di CPT1a nel fegato; tuttavia, l’isoforma CPT1ß non è influenzata . Studi precedenti hanno riportato che i livelli di malonil-CoA sono inversamente correlati con i tassi di β-ossidazione degli acidi grassi . Inoltre, studi su topi knockout ACC2 suggeriscono due pool cellulari separati di malonil-CoA, malonil-CoA prodotto da ACC1 (utilizzato principalmente per la lipogenesi) e un pool citosolico di malonil-CoA prodotto da ACC2 coinvolto nella regolazione di CPT1 e β-ossidazione degli acidi grassi .,
Β-ossidazione dell’acido grasso mitocondriale
La via di β-ossidazione dell’acido grasso:
La β-ossidazione dell’acido grasso è il processo di scomposizione di una molecola di acil-CoA a catena lunga in molecole di acetil-CoA. Il numero di acetil-CoA prodotto dipende dalla lunghezza del carbonio dell’acido grasso che viene ossidato. Questo processo coinvolge una varietà di enzimi, con i quattro enzimi principali coinvolti nella β-ossidazione degli acidi grassi essendo, nell’ordine, acil-CoA deidrogenasi, enoil-CoA idratasi, idrossiacil-CoA deidrogenasi e chetoacil-CoA tiolasi (Figura 3) ., Alla fine di ogni ciclo di β-ossidazione, si formano due nuove molecole, un acetil-CoA e un acil-CoA che sono due carboni più corti. Inoltre, durante la β-ossidazione si formano NADH e FADH2. Un FADH2 viene prodotto durante la reazione catalizzata dall’acil-CoA deidrogenasi. Un NADH è prodotto durante la reazione catalizzata da idrossiacil-CoA deidrogenasi. Il FADH2 e il NADH prodotti durante il processo di β-ossidazione degli acidi grassi sono utilizzati dalla catena di trasporto degli elettroni per produrre ATP., Esistono diverse isoforme di questi enzimi di β-ossidazione, che hanno affinità diverse per diverse lunghezze della catena di acidi grassi. Ad esempio, esiste una deidrogenasi acil-CoA a catena molto lunga, una deidrogenasi acil-CoA a catena lunga, una deidrogenasi acil-CoA a catena media e una deidrogenasi acil-CoA a catena corta. È interessante notare che l’idratasi enoil-CoA, l’idrossiacil-CoA deidrogenasi e le isoforme chetoacil-CoA specifiche per gli acidi grassi a catena lunga formano un complesso enzimatico sulla membrana mitocondriale interna.
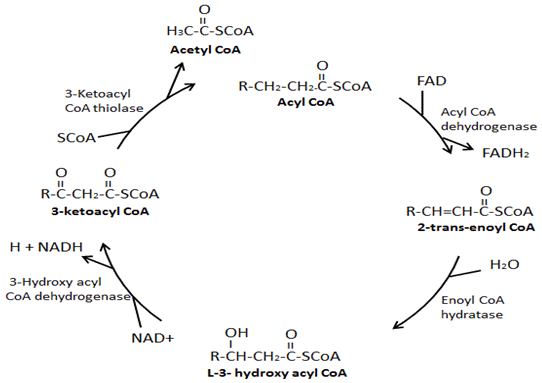
Figura 3., Siti di regolazione chiave di β-ossidazione degli acidi grassi
Β-ossidazione degli acidi grassi è regolata a più livelli. Questa figura mostra alcuni dei modi in cui l’acido grasso β-ossidazione è regolata. 1. La regolazione può avvenire a livello di ingresso di acidi grassi nella cellula. AMPK, PKC e PPARy regolano positivamente l’attività di CD36 / FATP. 2. La regolazione avviene anche attraverso la regolazione dei livelli di acetil-CoA e malonil-CoA. AMPK inibisce ACC, con conseguente aumento dei livelli di acetil-CoA / diminuzione dei livelli di malonil-CoA e aumento dell’ossidazione degli acidi grassi. Il malonil-CoA inibisce l’ossidazione degli acidi grassi inibendo CPT1., 3. La regolazione trascrizionale è anche coinvolta nella regolazione della β-ossidazione degli acidi grassi. PGC-1α, un coregulator di fattore di trascrizione ed il fattore di trascrizione PPARa agiscono nel nucleo per aumentare la trascrizione dei geni mitocondriali, dei geni di utilizzazione dell’acido grasso ed altri fattori di trascrizione.
Gli enzimi ausiliari sono necessari per la β-ossidazione degli acidi grassi insaturi e degli acidi grassi a catena dispari. Gli acidi grassi dispari sono suddivisi per β-ossidazione in molecole di acetil-CoA e propionil-CoA., Mentre il propionil-CoA potrebbe essere metabolizzato attraverso percorsi alternativi, viene metabolizzato principalmente nella cellula in succinil-CoA da tre enzimi (propionil-COA carbossilasi, metilmalonil-CoA epimerasi e metilmalonil-CoA mutasi) . Questo succinil-CoA può quindi entrare nel ciclo TCA. Rispetto agli acidi grassi pari, gli acidi grassi dispari si verificano raramente in natura . I due enzimi ausiliari, enoil-CoA isomerasi e 2,4-dienoil-CoA reduttasi sono necessari per la completa ossidazione degli acidi grassi insaturi ., Durante il ciclo di β-ossidazione in cui il legame cis-doppio inizia sul terzo carbonio dell’acil-CoA, il primo passo coinvolge l’isomerasi enoil-CoA isomerizzandola prima dell’idratasi enoil-CoA e gli altri due enzimi possono agire sull’acil-CoA. Un doppio legame su un carbonio pari richiede entrambi gli enzimi ausiliari. Una volta che il doppio legame si trova sul quarto carbonio dell’acil-CoA all’inizio di un ciclo di β-ossidazione, inizia ad essere ossidato. A seguito dell’azione dell’acil-CoA deidrogenasi, la 2,4-dienoil CoA reduttasi agisce sull’acil-CoA seguita dall’enoil-CoA isomerasi., L’idratasi enoil-CoA agisce quindi sull’acil-CoA e il processo riprende il suo ordine normale.
Controllo allosterico dell’ossidazione β degli acidi grassi:
L’attività degli enzimi dell’ossidazione β degli acidi grassi è influenzata dal livello dei prodotti delle loro reazioni . Ciascuno degli enzimi di β-ossidazione è inibito dall’intermedio acil-CoA grasso specifico che produce . È interessante notare che il 3-chetoacil-CoA può anche inibire l’enoil-CoA idratasi e l’acil-CoA deidrogenasi . la β-ossidazione può anche essere regolata allostericamente dal rapporto tra NADH / NAD + e livello di acetil-CoA / CoA., Un aumento dei rapporti NADH / NAD + o acetil-CoA / CoA provoca l’inibizione della β-ossidazione degli acidi grassi. Gli aumenti nel rapporto acetil-CoA/CoA hanno dimostrato specificamente di portare all’inibizione del feedback della chetoacil-CoA tiolasi .
La β-ossidazione degli acidi grassi può verificarsi anche nei perossisomi. Negli animali, si ritiene che i perossisomi siano importanti nella ripartizione iniziale degli acidi grassi a catena molto lunga e degli acidi grassi ramificati di metile . Gli enzimi coinvolti nell’ossidazione degli acidi grassi nei perossisomi sono diversi dai mitocondri., Una differenza importante è l’acil-CoA ossidasi, il primo enzima nella β-ossidazione del perossisoma, che trasferisce l’idrogeno all’ossigeno producendo H2O2 invece di produrre FADH2. L’H2O2 viene scomposto in acqua mediante catalasi. È importante sottolineare che gli intermedi grassi acil-CoA formati durante la β-ossidazione sono gli stessi nei perossisomi e nei mitocondri. I perossisomi contengono anche gli enzimi necessari per l’α-ossidazione, che sono necessari per l’ossidazione di alcuni acidi grassi con rami metilici.,
Regolazione trascrizionale della β-ossidazione degli acidi grassi:
Le proteine coinvolte nella β-ossidazione degli acidi grassi sono regolate da meccanismi trascrizionali e post-trascrizionali. Esistono numerosi fattori di trascrizione che regolano l’espressione di queste proteine. I recettori attivati dal proliferatore del perossisoma (PPARs) e un fattore di trascrizione coattivatore PGC-1α sono i regolatori trascrizionali più noti della β-ossidazione degli acidi grassi . I PPAR e il recettore X retinoide eterodimerizzano e si legano ai promotori genici contenenti l’elemento di risposta PPAR ., Esempi di proteine coinvolte nella β-ossidazione degli acidi grassi che sono regolate trascrizionalmente dalle PPARs includono FATP, acil-COA sintetasi (ACS), CD36/FAT, MCD, CPT1, acil-CoA deidrogenasi a catena lunga (LCAD) e acil-CoA deidrogenasi a catena media (MCAD). Il recettore α correlato all’estrogeno (ERRa) è stato anche implicato nella regolazione della β-ossidazione degli acidi grassi, avendo dimostrato di regolare anche la trascrizione del gene che codifica MCAD . I ligandi che si legano e modulano l’attività di PPARa, δ e γ includono acidi grassi .,
I geni regolati da ciascuno dei PPAR variano tra i tipi di tessuto. Ad esempio, il muscolo scheletrico PPARδ, ma non PPARa, upregulates espressione di CPT1 . Anche le isoforme PPAR sono espresse in modo differenziato tra i tipi di tessuto . Mentre la proteina PPARδ tende ad essere espressa in modo ubiquitario, PPARa è prevalentemente espressa in tessuti altamente metabolici (cioè cuore, muscolo scheletrico e fegato) e PPARy è prevalentemente espressa in tessuti come il tessuto adiposo . Fino a poco tempo fa, PPARy non si credeva di svolgere un ruolo significativo nella regolazione β-ossidazione degli acidi grassi., Tuttavia, recenti studi di knockout e sovraespressione hanno suggerito che PPARy può avere un ruolo nella regolazione dell’ossidazione β degli acidi grassi. L’eccessiva espressione di PPARy nei risultati del muscolo cardiaco aumenta i livelli di mRNA per le proteine β-ossidazione degli acidi grassi .
Il co-attivatore trascrizionale PGC-1α si lega e aumenta l’attività di PPARs e ERRa per regolare la β-ossidazione degli acidi grassi . PGC-1α modula l’attività di una serie di fattori di trascrizione che possono aumentare l’espressione delle proteine coinvolte nella β-ossidazione degli acidi grassi, nel ciclo TCA e nella catena di trasporto degli elettroni., Ad esempio, l’aumento dell’espressione proteica PGC-1α induce una massiccia biogenesi mitocondriale nel muscolo scheletrico .
PGC-1α è regolato sia a livello genico che proteico. AMPK aumenta l’attività della proteina PGC-1α preesistente attraverso due meccanismi proposti. Il primo è fosforilando PGC-1α sui risultati dei residui della serina e della treonina in un aumento globale dell’attività PGC-1α . AMPK può anche aumentare l’attività di PGC-1α attivando sirtuin 1 (SIRT1). SIRT1 può quindi deacetilare PGC-1α, aumentando la sua attività ., Si ritiene che AMPK aumenti i livelli di mRNA PGC-1α regolando il legame dei fattori di trascrizione a sequenze specifiche situate nel promotore del gene PGC-1α che includono due siti MEF, un sito di cAMP Response element (CRE) e la regione GATA/Ebox . AMPK regola i siti MEF fosforilando GEF, una proteina che può mediare il movimento di MEF2 nel nucleo . AMPK può aumentare il legame con il sito CRE mediante fosforilazione della proteina di legame dell’elemento cAMP-response (CREB) 1 e di altri membri della famiglia CREB che si legano alle regioni del promotore CRE ., Come un altro esempio, gli acidi grassi liberi possono anche regolare l’espressione proteica PGC-1α. Per esempio, una dieta ricca di grassi può elevare i livelli di PGC-1α nel muscolo scheletrico del ratto .
Conclusioni
La β-ossidazione degli acidi grassi è la principale via metabolica responsabile della rottura mitocondriale dell’acil-CoA a catena lunga in acetil-CoA. Questo processo comporta molti passaggi che sono regolati a livello trascrizionale e post-trascrizionale., La regolazione trascrizionale coinvolge PPARs, SREBP1 e PGC-1α, mentre il livello post-trascrizionale coinvolge principalmente il controllo allosterico della β–ossidazione degli acidi grassi, nonché la regolazione ACC, MCD e CPT. Entrambi i meccanismi lavorano in armonia per garantire una fornitura continua di acil-CoA a catena lunga per la β-ossidazione e prodotti di β-ossidazione per la produzione di energia mitocondriale.
Ringraziamenti: GDL è uno scienziato della Alberta Heritage Foundation per la ricerca medica