al final de la química gen, calcular los estados de oxidación de diferentes metales debería ser bastante familiar. Esto es lo que debes hacer. Tome un compuesto típico – \(FeCl_3\), por ejemplo. Trata cada enlace entre el metal y un átomo diferente como si fuera un enlace iónico. Eso significa que los elementos más electronegativos (como el cloro, por ejemplo, u oxígeno) tienen cargas negativas, y el elemento menos electronegativo (como el metal) tiene la carga positiva.,
si el compuesto es neutral, la suma de los estados de oxidación también tiene que ser neutral. (Si el compuesto tiene una carga, ajusta los estados de oxidación en consecuencia para que su suma sea igual a la carga).

Ahora aquí es un ejercicio divertido. Intente aplicar las mismas reglas al carbono. Se va a sentir un poco raro. ¿Por qué? Debido a que hay dos diferencias clave:
- Primero, el carbono es a menudo más electronegativo (2.5) que algunos de los átomos a los que está unido (como H, 2.2)., Entonces, ¿qué haces en este caso?
- En segundo lugar, a diferencia de los enlaces metal-metal, los enlaces carbono-carbono son ubicuos. Entonces, ¿cómo lidias con ellos?
Dos respuestas.
- en un enlace C-H, El H se trata como si tuviera un estado de oxidación de +1. Esto significa que cada enlace C-H disminuirá el estado de oxidación del carbono en 1.
- cualesquiera dos enlaces entre el mismo átomo no afectan el estado de oxidación (recordemos que el estado de oxidación de Cl en Cl-Cl (y el de H en H-H) es cero. Así que un carbono unido a 4 carbonos tiene un estado de oxidación de cero.,
así que a diferencia de los metales, que casi siempre están en un estado de oxidación positivo, el estado de oxidación del carbono puede variar ampliamente, de -4 (en CH4) a +4 (como en CO2). He aquí algunos ejemplos.
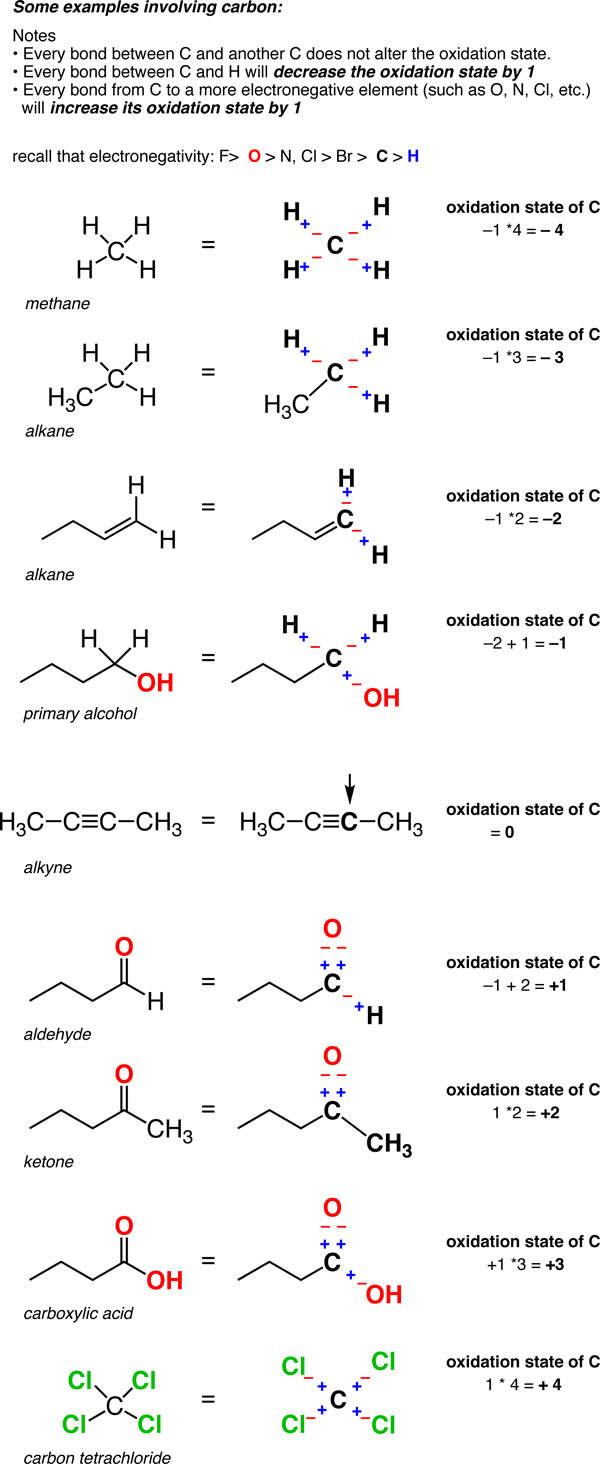
(no hay que olvidar que esta es llamado un «formalismo» por una razón. La carga sobre el carbono no es realmente +4 o -4. Pero el formalismo del Estado de oxidación nos ayuda a hacer un seguimiento de hacia dónde van los electrones, lo que nos será útil muy pronto).,
con una comprensión de cómo calcular los estados de oxidación en el carbono, estamos listos para el siguiente paso: comprender los cambios en el estado de oxidación en el carbono, a través de reacciones conocidas como oxidaciones (donde se incrementa el estado de oxidación) y reducciones (donde se reduce el estado de oxidación). Más sobre eso la próxima vez.