disulfuro de carbono propiedades químicas,Usos, Producción
usos
fabricación de fibras de rayón viscosa y película de celofán; disolvente para lípidos, azufre,caucho, fósforo, aceites, resinas y ceras; insecticida.
propiedades químicas
el disulfuro de carbono (bisulfuro de carbono; CS2; CASRN 75-15-0), en su forma pura, es un líquido incoloro que se evapora fácilmente a temperatura ambiente, con un olor aromático dulce similar al del cloroformo., Sin embargo, en su forma comercial y Reactiva impura, el disulfuro de carbono es un líquido amarillento con un olor fétido. Puede ser detectado por el olor a aproximadamente 1 ppm, pero el sentido del olfato se fatiga rápidamente y, por lo tanto, el olor no sirve como una buena propiedad de advertencia. Tiene una presión de vapor de 297mmHg y solubilidad en agua por peso de 0.3% a 20 ° C (68 °F). Una vez que el disulfuro de carbono está en el aire, se descompone en sustancias más simples pocos días después de su liberación (OEHHA, 2001).,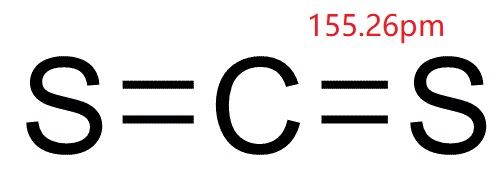
propiedades físicas
líquido claro, incoloro a amarillo pálido; olor etéreo cuando es puro. Los grados técnicos tienen un olor fuerte, asqueroso,podrido, similar al rábano. Leonardos et al. (1969) reportaron un umbral de olor en el aire de 210 ppbv.
usos
el disulfuro de carbono se utiliza en la fabricación de rayón de celulosa regenerada, celofán, desinfectantes del suelo y tubos de vacío electrónico. Otros usos importantes son la producción de tetracloruro de carbono, xantatos, tiocianatos, adhesivos de madera contrachapada y accesorios de caucho., También se utiliza como disolvente y eluante asan para sustancias orgánicas adsorbidas en análisis de aire de charcoalina.
usos
el disulfuro de carbono se utiliza como materia prima en la producción de cosas tales como rayón, celofán, semiconductores y tetracloruro de carbono, y para hacer algunos pesticidas. Se utiliza como solvente industrial e intermediario químico para disolver caucho para producir neumáticos (ATSDR, 1996), así como en fumigación de granos, investigación de Química Analítica, desengrase, limpieza en seco y extracción de aceite (Finkel et al., 1983)., Las fuentes naturales de disulfuro de carbono incluyen el océano abierto, las áreas costeras de alta actividad biológica, la reducción microbiana de sulfatos en el suelo, las marismas y algunas plantas superiores donde la fuente de disulfuro de carbono son las raíces de los árboles (Carroll, 1985; Khalil y Rasmussen, 1984).anteriormente, el disulfuro de carbono se utilizaba como plaguicida, donde se mezclaba típicamente con tetracloruro de carbono en una mezcla de 20/80, respectivamente. Esta mezcla se utilizó para exterminar insectos y roedores de vagones enteros de trigo, maíz, centeno y otros granos (Peters et al., 1988)., Los fumigadores de granos pueden estar agudamente intoxicados y pueden estar expuestos crónicamente al disulfuro de carbono. Por lo tanto, a finales del decenio de 1980, todos los plaguicidas que contenían disulfuro de carbono como ingrediente activo fueron cancelados por la Agencia de Protección Ambiental de los Estados Unidos (EPA de los Estados Unidos) (EPA de los Estados Unidos, 1999).
usos
en la fabricación de rayón, tetracloruro de carbono, xantogenatos, desinfectantes del suelo, tubos electrónicos de vacío. Disolvente para fósforo, azufre, selenio, bromo, yodo, grasas, resinas, cauchos.,
preparación
el disulfuro de carbono se fabrica calentando vapor de azufre con carbón vegetal y condensando vapores del compuesto formado. Alternativamente, se puede obtener calentando azufre con gas natural o fracciones de petróleo. En lugar de azufre, se puede usar H2S. La reacción ocurre a temperaturas muy altas. El producto obtenido en estas reacciones puede contener impurezas de azufre. El disulfuro de carbono se purifica por destilación.,
descripción general
el disulfuro de carbono puro es un líquido incoloro con un olor agradable similar al del cloroformo, mientras que el disulfuro de carbono impuro es un líquido amarillento con un olor desagradable, como el de los rábanos podridos. La exposición al disulfuro de carbono ocurre en los lugares de trabajo industriales. Las industrias asociadas con las plantas de gasificación del carbón liberan más disulfuro de carbono, sulfuro de carbonilo y sulfuro de hidrógeno. El disulfuro de carbono se utiliza en grandes cantidades como producto químico industrial para la producción de fibras de rayón viscosa., De hecho, la principal fuente de contaminación ambiental, tanto en interiores como en exteriores, por el disulfuro de carbono es causada por las emisiones liberadas al aire de las plantas de viscosa.
Air & reacciones al agua
altamente inflamable. Insoluble en agua.
perfil de reactividad
el disulfuro de carbono tiene una temperatura de autoignición extremadamente baja (125°C). Puede encenderse o incluso explotar cuando se calienta. Se sabe que el vapor o el líquido se inflaman al entrar en contacto con las tuberías de vapor, especialmente si se oxidan . Peligro de explosión cuando se expone a llamas, calor, chispas o fricción., Las mezclas con litio, sodio, potasio o tetraóxido de dinitrógeno pueden detonar cuando se produce una descarga eléctrica. Reacción potencialmente explosiva con óxido de nitrógeno, cloro, ácido permanganico (agentes oxidantes fuertes). El Vapor se enciende en contacto con polvo de aluminio o flúor. Reacciona violentamente con azidas, etilamina etilendiamina, etileno imina. Emite humos altamente tóxicos de óxidos de azufre cuando se calienta a la descomposición . La amida del sodio forma el gas tóxico e inflamable de H2S con CS2. (714)
Peligro
Un veneno. Tóxico por absorción cutánea. Fuego altamente inflamable, peligroso y riesgo de explosión, puede ser encendido por fricción., Límites de explosivos en el aire 1-50%. Carcinógeno cuestionable. Deterioro periférico del sistema NER-vous.
peligro para la salud
aunque el disulfuro de carbono presenta baja toxicidad en la mayoría de los animales de experimentación, su toxicidad es relativamente mayor en los seres humanos. La vía principal de exposición es la inhalación de vapores. También puede entrar en el cuerpo a través de la absorción de piel. El efecto tóxico de una sola exposición es la narcosis. La exposición repetida causa dolor de cabeza, mareos, fatiga, nerviosismo, insomnio, psicosis, irritación, temblores,pérdida de apetito, indigestión y trastornos gástricos., Los síntomas anteriores pueden manifestarse en humanos después de unos meses de exposición diaria de 4 horas a 150 ppm. Una concentración inferior a 30 ppm no produce efectos tóxicos notables. Una exposición de 15 minutos de 5000 ppm de disulfuro de carbono en el aire puede ser mortal para los seres humanos. La ingestión de 5-10 mL de líquido puede ser mortal. El valor oral de LD50 inrats está en el rango de 3000 mg/kg.Chapman et al. (1991) reportaron temblor en los dedos en humanos similar a la enfermedad de Parkinson idiopática resultante de pesticidas a base de disulfuro de carbono exposureto crónico., Los efectos similares neurotóxicos del pesticida disulfiram se han atribuido anteriormente a su metabolito,CS2 (Rainey Jr.1977). Sills et al. (2005) han llevado a cabo estudios de inhalación de neurotoxicidad del CS2 sobre los organismos objetivo del sistema nervioso central y las porciones distales de axones mielinizados largos del sistema nervioso periférico en ratas F344. Los autores observaron que CS2 producía reticulación de proteínas intra e intermoleculares in vivo. Tales covalentes entrecruzamiento en las proteínas del neurofilamento previo a la aparición de lesiones contribuyeron a las inflamaciones axonales neu-rofilamentosas.Chou et al., (2005) han investigado la Toxicidad cutánea inducida por CS2 en ratones y las alteraciones en la permeabilidad epidérmica que conducen a cambios fisiológicos y patológicos desde la exposición tópica a CS2. Los autores han postulado dos vías mecanicistas para explicar las alteraciones epidérmicas inducidas por CS2, una que implica depleción de lípidos intercelulares y la otra con daño de queratinocitos.
peligro de Incendio
temperatura de ignición peligrosamente baja: 212F. los vapores pueden encenderse por contacto con una bombilla ordinaria, cuando se calientan hasta la descomposición, el disulfuro de carbono emite vapores altamente tóxicos de óxidos de azufre., Cuando se calienta a la descomposición, emite humos altamente tóxicos de óxidos de azufre y puede reaccionar vigorosamente con materiales oxidantes. Evite el aire, el óxido, los halógenos, los azidos metálicos, los metales, los oxidantes; cuando se expone al calor o a la llama reacciona violentamente con Aluminio, cloro, azidos, hipoclorito, etilamina diamina, etileno imina, flúor, azidos metálicos de litio, potasio, cesio, rubidio y sodio, óxidos de nitrógeno, potasio, zinc y (ácido sulfúrico más permanganato). Se descompone en pie durante mucho tiempo.,
inflamabilidad y explotabilidad
el disulfuro de carbono es extremadamente inflamable y es un peligro de incendio peligroso (NFPArating = 3). Es tiene una alta presión de vapor y extremadamente baja autoignitiontemperature. Su vapor es más pesado que el aire y puede viajar una distancia considerable a una fuente de ignición y flash back. El vapor forma mezclas explosivas en el aire en concentraciones de 1,3 a 50%. El disulfuro de carbono puede ser encendido por superficies calientes como baños de vapor que normalmente no constituirían una fuente de ignición para otros vapores inflamables., El óxido (óxido de hierro) puede aumentar la probabilidad de ignición por superficies calientes. Los incendios de disulfuro de carbono deben extinguirse con CO2 o con productos químicos secos.
perfil de seguridad
un veneno humano por vía no especificada. Ligeramente tóxico para los humanos por inhalación. Un veneno experimental por vía intraperitoneal. Human reproductive effects on spermatogenesis by inhalation. Efectos teratogénicos y reproductivos experimentales. Datos de mutaciones humanas reportados., El principal efecto tóxico es sobre el sistema nervioso central, actuando como un narcótico y anestésico en la intoxicación aguda con la muerte después de la insuficiencia respiratoria. En la intoxicación crónica, el efecto sobre el sistema nervioso es de daño central y periférico, que puede ser permanente si el daño ha sido grave. Líquido inflamable. Un peligro de incendio peligroso cuando se expone al calor, las llamas, las chispas, la fricción o los materiales oxidantes. Riesgo de explosión grave cuando se expone al calor o a las llamas. Ignición y reacción potencialmente explosiva cuando se calienta en contacto con óxido o hierro., Mixtures with sodium or potassiumsodum alloys are powerful, shock-sensitive explosives. Explodes on contact with permanganic acid. Potentially explosive reaction with nitrogen oxide, chlorine (catalyzed by iron). Mixtures with dinitrogen tetraoxide are heat-, spark-, and shocksensitive explosives. Reacts with metal azides to produce shockand heat-sensitive, explosive metal azidodtthioformates. Aluminum powder ignites in CS2 vapor. The vapor ignites on contact with fluorine., Reacciona violentamente con azidas, CsN3, Cl0, etilamina diamina, etileno imina, PB (N3)2, LiN3, (H2SO4 + permanganatos), KN3, RBN3, NaN3, complejos de fenilcoppertrifenilfosfina. Incompatible con aire, metales, oxidantes. Para combatir el fuego, use agua, CO2, producto químico seco, Niebla, Niebla. Cuando se calienta a la descomposición emite humos altamente tóxicos de SO,.,
exposición potencial
el disulfuro de carbono se utiliza en la fabricación de rayón viscosa; sales de amonio; tetracloruro de carbono; carbanilida, genatos de Xanto; agentes de flotación; Desinfectantes de suelo; colorantes; tubos electrónicos de vacío; vidrio óptico;pinturas, esmaltes, removedores de pintura; barnices; removedores de barniz; sebo, textiles, explosivos; combustible para cohetes; masilla; conservantes y cemento de caucho; como solvente para fósforo, azufre,selenio, bromo, yodo; celulosa alcalina; grasas, ceras,lacas, alcanfor, resinas y caucho vulcanizado en frío., También se utiliza en desengrase; análisis químico; galvanoplastia; fumigación de granos; extracción de aceite; y limpieza en seco. Es ampliamente utilizado como un plaguicida intermedio.
Source
Identified among 139 volatile compounds identified in cantaloupe (Cucumis melo var.reticula cv. Sol Real) utilizando un método automatizado de microextracción de fase sólida en el espacio de cabeza rápido (Beaulieu y Grimm, 2001).
destino ambiental
químico/físico. El disulfuro de carbono se hidroliza en soluciones alcalinas a dióxido de carbono y disulfuro de hidrógeno (Peyton et al., 1976).,en una solución alcalina acuosa que contiene peróxido de hidrógeno, ditiopercarbonato, sulfuro, azufre elemental y polisulfuros se puede esperar que se formen (Elliott, 1990). En una solución alcalina acuosa (pH ≥8), disulfuro de carbono reaccionado con peróxido de hidrógeno formando iones sulfato y carbonato. Sin embargo, cuando el pH se reduce a 7-7.4, se forma azufre coloidal (Adewuyi y Carmichael, 1987).la solución Anaquea que contiene disulfuro de carbono reacciona con hipoclorito de sodio formando dióxido de carbono, ácido sulfúrico y cloruro de sodio (Patnaik, 1992)., Forma un hemihidrato que se descompone a -3 ° C (Keith y Walters, 1992).Fumigantes agrícolas quemados con una llama azul que libera dióxido de carbono y dióxido de azufre (Windholz et al.,1983). Emite óxidos de azufre muy tóxicos cuando se calienta a la descomposición (Lewis, 1990).El disulfuro de carbono se oxida en la troposfera produciendo sulfuro de carbonilo. Los períodos de semidesintegración atmosférica del disulfuro de carbono y el sulfuro de carbonilo se estimaron en aproximadamente 2 años y 13 días, respectivamente (Khalil y Rasmussen, 1984).,
almacenamiento
el carbondisulfuro debe usarse solo en áreas libres de fuentes de ignición (incluidas placas calientes,bombillas incandescentes y baños de vapor), y esta sustancia debe almacenarse en recipientes metálicos herméticamente sellados en áreas separadas de los oxidantes.
envío
disulfuro de carbono UN1131, clase de peligro: 3; Etiquetas: 3-Líquido inflamable, 6.1-materiales venenosos.,
Métodos de purificación
agítelo durante 3 horas con tres porciones de solución KMnO4 (5g / L), dos veces durante 6 horas con mercurio (para eliminar las impurezas de sulfuro) hasta que no se produzca un mayor oscurecimiento de la interfaz, y finalmente con una solución de HgSO4 (2.5 g/L) o HgCl2 frío y saturado. Seque con CaCl2, MgSO4 o CaH2 (con posterior secado por reflujo sobre P2O5), seguido de destilación fraccionada en luz difusa. Los metales alcalinos no se pueden utilizar como agentes de secado. También se ha purificado al ponerse de pie con bromo (0.,5 ml / L) durante 3-4 horas, agitando rápidamente con solución de KOH, luego torneado de cobre (para eliminar el bromo sin reaccionar) y secado con CaCl2. CS2 es altamente tóxico y altamente inflamable. Trabajar en una buena fumehood. Se han purificado pequeñas cantidades de CS2 (incluida la eliminación de hidrocarburos) mediante agitación mecánica de una muestra de 45-50g con una solución de 130g de sulfuro de sodio en 150mL de H2O durante 24 horas a 35-40o. la solución acuosa de tiocarbonato de sodio se separa de CS2 sin reaccionar, luego se precipita con 140g de sulfato de cobre en 350g de agua, con enfriamiento., Después de filtrar el tiocarbonato de cobre, se descompone pasando vapor en él. El destilado se separa del H2O y se destila del P2O5.
incompatibilidades
incompatibles con oxidantes (cloratos,nitratos, peróxidos, permanganatos, percloratos, cloro, bromo, flúor, etc.); el contacto puede causar incendios o explosiones. Mantener alejado de materiales alcalinos, bases fuertes, ácidos fuertes, oxoácidos, epóxidos. También es incompatible con metales químicamente activos (como sodio, potasio, zinc), azidas, aminas orgánicas, Halógenos. Puede descomponerse explosivamente por choque, fricción o conmoción cerebral., Puede explotar al calentarse. La sustancia puede inflamarse espontáneamente en contacto con el aire y en contacto con superficies calientes, produciendo vapores tóxicos de dióxido de azufre. Reacciona violentamente con oxidantes para producir óxidos de azufre y monóxido de carbono, y causar peligro de incendio y explosión. Ataca algunas formas de plástico, caucho y revestimiento.
eliminación de residuos
este compuesto es un líquido muy inflamable que se evapora rápidamente. Se quema con un Blueflame a dióxido de carbono (inofensivo) y dióxido de azufre.El dióxido de azufre tiene un fuerte olor sofocante; 1000 ppm inair es letal para las ratas., El líquido puro presenta un fuego agudo y peligro de explosión. Se sugiere el siguiente procedimiento de eliminación: todos los equipos o superficies de contacto deben rodearse para evitar la ignición por cargas estáticas. Absorber en vermiculita, arena o cenizas y cubrir con agua. Transfiera el agua en cubos a un área abierta. Encienda desde una distancia con un rastro de excelsior. Si la cantidad es grande, el disulfuro de carbono puede recuperarse por destilación y reembalarse para su uso.
precauciones
durante el manejo de disulfi de carbono, los trabajadores ocupacionales requieren ropa adecuada, protección para los ojos y protección respiratoria., Los trabajadores deben usar el producto químico bajo un manejo entrenado. En contacto con los ojos, Inmediatamente fl ush con grandes cantidades de agua. En contacto con la piel, el trabajador debe quitarse rápidamente la ropa contaminada y llamar inmediatamente a atención médica