visión general
La β-oxidación de ácidos grasos es un proceso de varios pasos por el cual los ácidos grasos son descompuestos por varios tejidos para producir energía. Los ácidos grasos ingresan principalmente a una célula a través de transportadores de proteínas de ácidos grasos en la superficie celular . Los transportadores de ácidos grasos incluyen translocasa de ácidos grasos (FAT / CD36), proteínas de transporte de ácidos grasos específicos del tejido (FATP) y proteína de unión de ácidos grasos unidos a la membrana plasmática (FABPpm). Una vez dentro de la célula, un grupo CoA se agrega al ácido graso por la acil-CoA sintasa grasa (FACS), formando acil-CoA de cadena larga., Carnitina palmitoiltransferasa 1 (CPT1) la conversión de la acil-CoA de cadena larga a acilcarnitina de cadena larga permite que la fracción de ácidos grasos sea transportada a través de la membrana mitocondrial interna a través de la translocasa de carnitina (CAT), que intercambia acilcarnitinas de cadena larga por carnitina. Una membrana mitocondrial interna CPT2 convierte la acilcarnitina de cadena larga en acil-CoA de cadena larga. El acil-CoA de cadena larga entra en la vía de β-oxidación de ácidos grasos, lo que resulta en la producción de un acetil-CoA de cada ciclo de β-oxidación de ácidos grasos., Este acetil-CoA entonces entra en el ciclo del ácido tricarboxílico mitocondrial (TCA). El NADH y el FADH2 producidos por la β-oxidación de ácidos grasos y el ciclo de TCA son utilizados por la cadena de transporte de electrones para producir ATP. En la Figura 1 se ofrece una visión general de la oxidación de ácidos grasos.

la Figura 1. Descripción general de la oxidación de ácidos grasos
La β-oxidación de ácidos grasos es el proceso por el cual los ácidos grasos se descomponen para producir energía. Los ácidos grasos ingresan principalmente a una célula a través de transportadores de proteínas de ácidos grasos en la superficie celular., Una vez dentro, FACS agrega un grupo CoA al ácido graso. CPT1 luego convierte el acil-CoA de cadena larga en acilcarnitina de cadena larga. El grupo de ácidos grasos es transportado por el gato a través de la membrana mitocondrial interna. CPT2 luego convierte la acilcarnitina de cadena larga en acil-CoA de cadena larga. El acil-CoA de cadena larga puede entonces entrar en la vía de β-oxidación de ácidos grasos, resultando en la producción de un acetil-CoA de cada ciclo de β-oxidación. Este acetil-CoA entonces entra en el ciclo de TCA., El NADH y el FADH2 producidos por la β-oxidación y el ciclo TCA son utilizados por la cadena de transporte de electrones para producir ATP.
papel del suministro de ácidos grasos en la regulación de la β-oxidación de ácidos grasos
transporte celular de ácidos grasos:
ha habido un esfuerzo considerable en los últimos años para dilucidar los mecanismos por los cuales los ácidos grasos son absorbidos por las células, particularmente determinando si los ácidos grasos son transportados a través de la membrana celular por difusión simple o si este transporte es facilitado por proteínas asociadas a la membrana., Si bien varios resultados apoyan ambos métodos de transporte, se cree que el transporte por proteínas asociadas a la membrana es el medio predominante de absorción de ácidos grasos en las células . Se han identificado varias proteínas de membrana que facilitan la absorción de ácidos grasos celulares. Los transportadores de ácidos grasos asociados a la membrana CD36 / FAT, FABPpm y FATPs difieren en su peso molecular y grado de modificación post-traslacional . Stremmel et al. reportó que los anticuerpos dirigidos contra el hígado de rata FABPpm inhiben la captación de ácidos grasos por los hepatocitos, adipocitos y cardiomiocitos en un 50-75%., Este resultado sugirió que una porción significativa de la absorción de ácidos grasos depende del transporte mediado por proteínas en diferentes tipos de células .
Schaffer y Lodish descubrieron FATP mediante el uso de una estrategia de clonación de expresión en adipocitos . La expresión de esta proteína de membrana integral de 63 kDa en una línea celular de fibroblastos estable resultó en un aumento de 3-4 veces en el transporte de ácidos grasos de cadena larga. La identificación de esta primera FATP llevó al descubrimiento de varias otras isoformas de FATP (FATP1-6) . FATP1 se expresa predominantemente en el corazón y los músculos esqueléticos ., FATP2 y FATP5 se expresan principalmente en el hígado, donde están involucrados en el metabolismo lipídico hepático en asociación con la acil-CoA sintetasa. FATP4 es esencial para la absorción de lípidos dietéticos y tiene un papel crítico en la estructura y función normal de la piel. Hasta la fecha, se ha demostrado que FATP3 y FATP6 tienen poca o ninguna función de transporte de ácidos grasos .
el papel de la proteína de membrana CD36 / grasa en la captación de ácidos grasos y la β-oxidación en mamíferos ha sido ampliamente estudiado., CD36 / FAT es una proteína de membrana translocasa de ácidos grasos de 88 kDa expresada en proporción a la tasa de oxidación de ácidos grasos en el tejido muscular (por ejemplo, se expresa más en el corazón que en el músculo esquelético) . CD36 / FAT está involucrado en la angiogénesis y la inflamación, así como en el metabolismo de los lípidos. La transfección de fibroblastos con CD36 / grasa produjo un aumento de las tasas de captación de ácidos grasos . A diferencia de FATP, CD36 / FAT tiene la capacidad de translocarse entre los endosomas intracelulares y la membrana plasmática de las células, lo que permite que CD36/FAT desempeñe un papel crítico en la regulación de la absorción de ácidos grasos., La insulina y la contracción muscular pueden estimular la translocación CD36/grasa de las reservas intracelulares a la membrana plasmática, lo que conduce a una mayor absorción y β-oxidación de los ácidos grasos. La activación de FOXO1 puede conducir a la translocación de CD36/grasa que resulta en un aumento de la β-oxidación de ácidos grasos junto con la acumulación de triacilglicerol . Esto sugiere un papel significativo de la señalización intracelular en la función CD36 / FAT.
el mecanismo exacto que induce la translocación CD36 / FAT es todavía desconocido., Sin embargo, se supone que la activación de la proteína quinasa activada por AMP (AMPK) y el estado energético de las células musculares pueden participar en la respuesta de translocación CD36/grasa . Además, la estimulación de la proteína quinasa C (PKC) en cardiomiocitos induce la translocación CD36/grasa, indicando un posible papel del calcio en el proceso de translocación . Por otro lado, la inhibición de la cinasa extracelular del receptor de señalización (ERK) puede bloquear la contracción muscular inducida por la translocación CD36/grasa ., La modificación post-traslacional de CD36 / grasa a través de la ubiquitinación también puede regular los niveles de proteína intracelular de CD36 / grasa al dirigirse a la proteína para su degradación. Por lo tanto, la insulina aumenta la disponibilidad de CD36/grasa para la translocación por inhibición de la ubiquitinación. Sin embargo, los ácidos grasos promueven la ubiquitinación, lo que conduce a la degradación de CD36/grasa .
esterificación de ácidos grasos a acil-CoA:
un ácido graso debe convertirse en acil-CoA graso para que entre en las mitocondrias y se oxide ., La enzima responsable de la esterificación de ácidos grasos a acil-CoA de cadena larga es FACS. Para esta reacción, FACS consume el equivalente de dos ATP. Otra enzima, la tioesterasa citosólica (CTE), puede eliminar el CoA convirtiendo el acil-CoA graso en un ácido graso. El acil-CoA graso puede convertirse en acil carnitina, lo que le permite ser transportado a las mitocondrias y entrar en la β-oxidación de ácidos grasos o convertirse en metabolitos lipídicos (triacilglicerol, diacilglicerol, ceramida, etc.).,
el eje acetil-CoA carboxilasa, malonil-CoA descarboxilasa, malonil-CoA:
Acetil-CoA carboxilasa (ACC) es una enzima Central involucrada en la β-oxidación de ácidos grasos y la biosíntesis de ácidos grasos. ACC cataliza la carboxilación de acetil-CoA produciendo malonil-CoA, que puede ser utilizado por la sintasa de ácidos grasos para la biosíntesis de ácidos grasos . Mientras que el malonil-CoA se usa como sustrato para la biosíntesis de ácidos grasos, el malonil-CoA también es un potente inhibidor de la captación de ácidos grasos mitocondriales secundario a la inhibición de CPT1 (Figura 2) ., Hay dos formas de ACC, una isoforma ACC1 de 265 kDa, que se expresa altamente en el hígado y el tejido adiposo, y una isoforma ACC2 de 280 kDa que es más específica para órganos altamente metabólicos como el músculo esquelético y el corazón . AMPK juega un papel importante en la regulación de ACC1 y ACC2 fosforilando e inhibiendo la actividad de ACC. En situaciones de aumento de la demanda de energía, AMPK se activa, donde luego fosforila e inactiva ambas isoformas de ACC (Figura 3). La inhibición de ACC2 puede conducir a un aumento en la β-oxidación de ácidos grasos, mientras que la biosíntesis de ácidos grasos disminuye cuando se inhibe ACC1 .,

la Figura 2. La vía de β-oxidación de ácidos grasos
Las cuatro enzimas principales involucradas en la β-oxidación son: acil-CoA deshidrogenasa, enoil-CoA hidratasa, hidroxi acil-CoA deshidrogenasa y cetoacil-CoA tiolasa. La acil-CoA deshidrogenasa crea un doble enlace entre el segundo y tercer carbonos del grupo CoA en acil-CoA y en el proceso produce un FADH2., A continuación, la enoil-coa hidratasa elimina el doble enlace recién formado, en el proceso de agregar un grupo hidroxilo al tercer carbono desde el grupo CoA y un hidrógeno en el segundo carbono desde el grupo CoA. La hidroxiacil-CoA deshidrogenasa elimina el hidrógeno en el grupo hidroxilo que acaba de unirse y en el proceso produce un NADH. En el paso final, la cetoacil-CoA tiolasa une un grupo CoA al tercer carbono del grupo CoA, lo que resulta en la formación de dos moléculas, una acetil-CoA y una acil-CoA que son dos carbonos más cortos.,
la regulación a largo plazo del ACC depende de la regulación de su expresión génica. Varios factores transcripcionales pueden regular la expresión génica del ACC, incluyendo la proteína de unión al elemento regulador de esteroles (srebp1a y SREBP1c) y la proteína de unión al elemento de respuesta de carbohidratos (ChREBP) . SREBP está regulada por la insulina, que promueve el retículo endoplásmico SREBP1c para ser escindido y translocado al núcleo, lo que lleva a la estimulación de la expresión de ACC., Por otra parte, los factores de transcripción peroxisoma proliferador activado receptor γ coactivador 1 (PGC-1) α y β puede estimular la expresión de SREBP1a y SREBP1c, ambos de los cuales tienen un papel vital en la lipogénesis. La expresión de ChREBP puede ser inducida por altas concentraciones de glucosa, lo que resulta en la chrebp activada promoviendo la expresión de ACC1 y la sintasa de ácidos grasos . El factor respiratorio Nuclear-1 (NRF-1) es un modulador principal de la expresión de proteínas mitocondriales y la biogénesis mitocondrial, los cuales son importantes para una mayor capacidad de β-oxidación de ácidos grasos mitocondriales ., Por ejemplo, Adam et al. mostró que la sobreexpresión NRF-1 resulta en la inhibición de la actividad promotora del gen ACC2 en el corazón de los mamíferos, lo que mejora las tasas de β-oxidación de ácidos grasos mitocondriales, promoviendo así la capacidad energética intracelular general .
La malonil-CoA descarboxilasa (MCD) es la enzima responsable de la descarboxilación de malonil-CoA a acetil-CoA . En general, el nivel de malonil-CoA disminuye cuando se incrementa la actividad de MCD, lo que resulta en una tasa elevada de oxidación de ácidos grasos., Se ha reportado que las proteínas quinasas que fosforilan e inhiben el ACC podrían activar la MCD . Sin embargo, MCD parece ser regulado principalmente por medios transcripcionales (discutido más adelante). Por lo tanto, MCD y ACC parecen trabajar en armonía para regular la piscina de malonil-CoA que puede inhibir CPT1 .
carnitina palmitoil transferasa mitocondrial (CPT):
la isoforma CPT, CPT1, reside en la superficie interna de la membrana mitocondrial externa y es un sitio principal de regulación de la captación de ácidos grasos mitocondriales ., Como se mencionó, CPT1 es potencialmente inhibido por malonil-CoA, el producto del ACC que se une al lado citosólico de CPT1. Los mamíferos expresan tres isoformas de CPT1, que están codificadas por diferentes genes. La isoforma hepática (CPT1a), la isoforma muscular (CPT1ß) y una tercera isoforma de CPT1 (CPT1c), que se expresa principalmente en el cerebro y los testículos . Más específicamente, el corazón expresa dos isoformas de CPT1, una isoforma de 82 KDa (CPT1a) y la isoforma predominante de 88 KDa (CPT1ß) (que tiene la mayor sensibilidad a la inhibición de malonil-CoA)., La insulina y la hormona tiroidea pueden regular la sensibilidad de CPT1a en el hígado; sin embargo, la isoforma CPT1ß no se ve afectada . Estudios previos han reportado que los niveles de malonil-CoA están inversamente correlacionados con las tasas de β-oxidación de ácidos grasos . Además, los estudios en ratones knockout ACC2 sugieren dos piscinas celulares separadas de malonil-CoA, malonil-CoA producido por ACC1 (utilizado principalmente para la lipogénesis), y una piscina citosólica de malonil-CoA producido por ACC2 involucrado en la regulación de CPT1 y β-oxidación de ácidos grasos .,
β-oxidación del ácido graso mitocondrial
La Vía de β-oxidación del ácido graso:
La β-oxidación del ácido graso es el proceso de descomponer una molécula de acil-CoA de cadena larga en moléculas de acetil-CoA. El número de acetil-CoA producido depende de la longitud de carbono del ácido graso que se oxida. Este proceso involucra una variedad de enzimas, con las cuatro enzimas principales involucradas en la β-oxidación de ácidos grasos siendo, en orden, acil-CoA deshidrogenasa, enoil-CoA hidratasa, hidroxiacil-CoA deshidrogenasa y cetoacil-CoA tiolasa (Figura 3) ., Al final de cada ciclo de β-oxidación, se forman dos nuevas moléculas, una acetil-CoA y una acil-CoA que es dos carbonos más cortos. Además, durante la β-oxidación se forman NADH y FADH2. Un FADH2 se produce durante la reacción catalizada por la acil-CoA deshidrogenasa. Un NADH se produce durante la reacción catalizada por la hidroxiacil-CoA deshidrogenasa. El FADH2 y el NADH producidos durante el proceso de β-oxidación de ácidos grasos son utilizados por la cadena de transporte de electrones para producir ATP., Hay diferentes isoformas de estas enzimas de β-oxidación, que tienen diferentes afinidades para diferentes longitudes de cadena de ácidos grasos. Por ejemplo, hay una acil-CoA deshidrogenasa de cadena muy larga, una acil-CoA deshidrogenasa de cadena larga, una acil-CoA deshidrogenasa de cadena media y una acil-CoA deshidrogenasa de cadena corta. Curiosamente, las isoformas enoil-CoA hidratasa, hidroxiacil-CoA deshidrogenasa y cetoacil-CoA específicas para los ácidos grasos de cadena larga forman un complejo enzimático en la membrana mitocondrial interna.
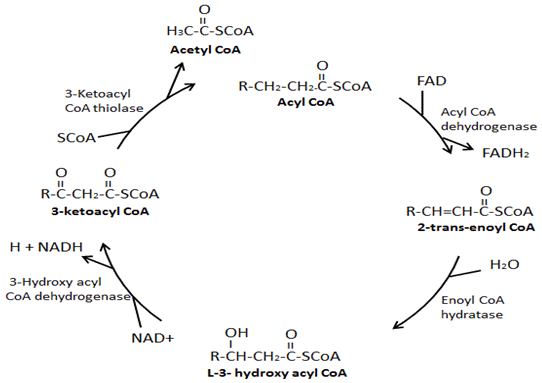
la Figura 3., Sitios clave de regulación de la β-oxidación de ácidos grasos
La β-oxidación de ácidos grasos se regula en múltiples niveles. Esta figura muestra algunas de las formas en que se regula la β-oxidación de ácidos grasos. 1. La regulación puede ocurrir a nivel de entrada de ácidos grasos en la célula. AMPK, PKC y PPARy regulan positivamente la actividad de CD36 / FATP. 2. La regulación también ocurre a través de la regulación de los niveles de acetil-CoA y malonil-CoA. La AMPK inhibe el ACC, lo que resulta en un aumento de los niveles de acetil-CoA/disminución de los niveles de malonil-CoA y un aumento de la oxidación de ácidos grasos. Malonil-CoA inhibe la oxidación de ácidos grasos mediante la inhibición de CPT1., 3. La regulación transcripcional también está involucrada en la regulación de la β-oxidación de ácidos grasos. PGC-1α, un corregulador del factor de transcripción, y el factor de transcripción PPARa actúan en el núcleo para aumentar la transcripción de genes mitocondriales, genes de utilización de ácidos grasos y otros factores de transcripción.
Las enzimas auxiliares son necesarias para la β-oxidación de ácidos grasos insaturados y ácidos grasos de cadena impar. Los ácidos grasos impares se descomponen por β-oxidación a moléculas de acetil-CoA y propionil-CoA., Mientras que el propionil-CoA podría ser metabolizado a través de vías alternativas, se metaboliza principalmente en la célula a succinil-CoA por tres enzimas (propionil-coa carboxilasa, metilmalonil-coa epimerasa y metilmalonil-coa mutasa). Este succinil-CoA puede entonces entrar en el ciclo del TCA. En comparación con los ácidos grasos pares, los ácidos grasos impares ocurren con poca frecuencia en la naturaleza . Las dos enzimas auxiliares, enoil-coa isomerasa y 2,4-dienoil-CoA reductasa son necesarias para la oxidación completa de ácidos grasos insaturados ., Durante el ciclo de β-oxidación en el que el enlace CIS-doble comienza en el tercer carbono de la acil-CoA, el primer paso implica la isomerasa enoil-CoA isomerizándola antes de que la enoil-CoA hidratasa, y las otras dos enzimas, puedan actuar sobre la acil-CoA. Un doble enlace en un carbono par requiere ambas enzimas auxiliares. Una vez que el doble enlace está en el cuarto carbono del acil-CoA al comienzo de un ciclo de β-oxidación, comienza a oxidarse. Tras la acción de la acil-CoA deshidrogenasa, la 2,4-dienoil CoA reductasa actúa sobre la acil-CoA seguida de la enoil-CoA isomerasa., Enoil-coa hidratasa entonces actúa sobre el acil-CoA y el proceso reanuda su orden normal.
control alostérico de β-oxidación de ácidos grasos:
la actividad de las enzimas de β-oxidación de ácidos grasos se ve afectada por el nivel de los productos de sus reacciones . Cada una de las enzimas de β-oxidación es inhibida por el intermedio de acil-CoA graso específico que produce . Curiosamente, la 3-cetoacil-CoA también puede inhibir la enoil-coa hidratasa y la acil-CoA deshidrogenasa . La β-oxidación también puede ser regulada alostéricamente por la relación de NADH / NAD+ y el nivel de acetil-CoA / CoA., Un aumento en las relaciones NADH/NAD+ o acetil-CoA/CoA resulta en la inhibición de la β-oxidación de ácidos grasos. Se ha demostrado específicamente que los aumentos en la relación acetil-CoA/CoA conducen a la inhibición por retroalimentación de la cetoacil-CoA tiolasa .
La β-oxidación del ácido graso también puede ocurrir en los peroxisomas. En animales, se cree que los peroxisomas son importantes en la descomposición inicial de ácidos grasos de cadena muy larga y ácidos grasos ramificados con metilo . Las enzimas involucradas en la oxidación de ácidos grasos en los peroxisomas son diferentes de las mitocondrias., Una diferencia importante es la acil-CoA oxidasa, la primera enzima en la β-oxidación del peroxisoma, que transfiere el hidrógeno al oxígeno produciendo H2O2 en lugar de producir FADH2. El H2O2 se descompone en agua por catalasa. Es importante destacar que los intermedios grasos acil-CoA formados durante la β-oxidación son los mismos en peroxisomas y mitocondrias. Los peroxisomas también contienen las enzimas necesarias para la α-oxidación, que son necesarias para la oxidación de algunos ácidos grasos con ramas metílicas.,
regulación transcripcional de la β-oxidación de ácidos grasos:
las proteínas involucradas en la β-oxidación de ácidos grasos están reguladas por mecanismos transcripcionales y post-transcripcionales. Hay una serie de factores de transcripción que regulan la expresión de estas proteínas. Los receptores activados por proliferadores de peroxisomas (PPARs) y un coactivador del factor de transcripción PGC-1α son los reguladores transcripcionales más conocidos de la β-oxidación de ácidos grasos . Los PPAR y el receptor retinoide x heterodimerizan y se unen a promotores de genes que contienen el elemento de respuesta PPAR ., Ejemplos de proteínas involucradas en la β-oxidación de ácidos grasos que son reguladas transcripcionalmente por los PPARs incluyen FATP, acil-CoA sintetasa (ACS), CD36/FAT, MCD, CPT1, acil-CoA deshidrogenasa de cadena larga (LCAD), y acil-CoA deshidrogenasa de cadena media (MCAD) . El receptor α relacionado con el estrógeno (ERRa) también se ha implicado en la regulación de la β-oxidación de ácidos grasos, habiéndose demostrado que también regula la transcripción del gen que codifica MCAD . Los ligandos que se unen y modulan la actividad de PPARa, δ y γ incluyen ácidos grasos .,
los genes regulados por cada uno de los PPAR varían entre los tipos de tejido. Por ejemplo, músculo esquelético PPARδ, pero no PPARa, upregulates expresión de CPT1 . Las isoformas PPAR también se expresan diferencialmente entre los tipos de tejido . Mientras que la proteína PPARδ tiende a expresarse ubicuamente, PPARa se expresa predominantemente en tejidos altamente metabólicos (es decir, corazón, músculo esquelético e hígado) y PPARy se expresa predominantemente en tejidos como el tejido adiposo . Hasta hace poco, no se creía que PPARy desempeñara un papel significativo en la regulación de la β-oxidación de ácidos grasos., Sin embargo, estudios recientes de knockout y sobreexpresión han sugerido que PPARy puede tener un papel en la regulación de la β-oxidación de ácidos grasos. Sobre expresar PPARy en los resultados del músculo cardíaco en niveles crecientes del ARNm para las proteínas de la β-oxidación del ácido graso .
el coactivador transcripcional PGC-1α se une y aumenta la actividad de PPARs y ERRa para regular la β-oxidación de ácidos grasos . PGC-1α modula la actividad de una serie de factores de transcripción que pueden aumentar la expresión de proteínas involucradas en la β-oxidación de ácidos grasos, el ciclo de TCA, y la cadena de transporte de electrones., Por ejemplo, el aumento de la expresión de la proteína PGC-1α induce la biogénesis mitocondrial masiva en el músculo esquelético .
PGC-1α está regulado tanto a nivel de genes como de proteínas. AMPK aumenta la actividad de la proteína preexistente PGC-1α a través de dos mecanismos propuestos. El primero es fosforilar PGC-1α en los residuos de treonina y serina resulta en un aumento general de la actividad PGC-1α . AMPK también puede aumentar la actividad de PGC-1α activando sirtuin 1 (SIRT1). SIRT1 puede entonces desacetilar PGC-1α, aumentando su actividad ., Se cree que la AMPK aumenta los niveles de ARNm PGC-1α regulando la Unión de factores de transcripción a secuencias específicas ubicadas en el promotor del gen PGC-1α que incluyen dos sitios MEF, un sitio de elemento de respuesta cAMP (CRE) y la región GATA/Ebox . AMPK regula los sitios MEF fosforilando GEF, una proteína que puede mediar el movimiento de MEF2 en el núcleo . La AMPK puede aumentar la unión al sitio de CRE por fosforilación de la proteína de unión del elemento de respuesta cAMP (CREB) 1 y otros miembros de la familia CREB que se unen a las regiones promotoras de CRE ., Como otro ejemplo, los ácidos grasos libres también pueden regular la expresión de la proteína PGC-1α. Por ejemplo, una dieta alta en grasas puede elevar los niveles de PGC-1α en el músculo esquelético de la rata .
conclusiones
La β-oxidación de ácidos grasos es la principal vía metabólica que es responsable de la descomposición mitocondrial de acil-CoA de cadena larga a acetil-CoA. Este proceso involucra muchos pasos que son regulados a nivel transcripcional y post-transcripcional., La regulación transcripcional involucra PPARs, SREBP1 y PGC-1α, mientras que el nivel post–transcripcional involucra principalmente el control alostérico de la β-oxidación de ácidos grasos, así como la regulación de ACC, MCD y CPT. Ambos mecanismos trabajan en armonía para asegurar un suministro continuo de acil-CoA de cadena larga para la β-oxidación, y productos de β-oxidación para la producción de energía mitocondrial.
agradecimientos: GDL es un científico de la Fundación Alberta Heritage para la Investigación Médica