en 1911 los componentes del átomo había sido descubierta. El átomo consistía en partículas subatómicas llamadas protones y electrones. Sin embargo, no estaba claro cómo estos protones y electrones estaban dispuestos dentro del átomo. J. J. Thomson sugirió el modelo de «pudín de ciruela». En este modelo, los electrones y protones se mezclan uniformemente en todo el átomo:

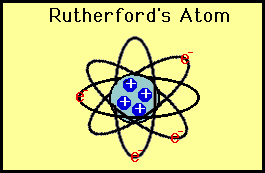
Rutherford probó la hipótesis de Thomson ideando su experimento de «lámina de oro»., Rutherford razonó que si el modelo de Thomson era correcto, entonces la masa del átomo se extendía por todo el átomo. Entonces, si disparó partículas alfa de alta velocidad (núcleos de helio) a un átomo, entonces habría muy poco para desviar las partículas alfa. Decidió probar esto con una fina película de átomos de oro. Como era de esperar, la mayoría de las partículas alfa pasaron a través de la lámina de oro, pero para su sorpresa algunas partículas alfa rebotaron casi directamente hacia atrás.
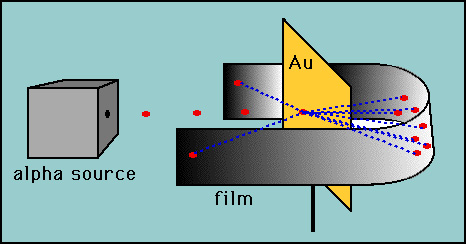
Estas desviaciones no eran consistentes con el de Thomson modelo., Rutherford se vio obligado a descartar el modelo de pudín de ciruela y razonó que la única manera en que las partículas alfa podían desviarse hacia atrás era si la mayor parte de la masa en un átomo se concentraba en un núcleo. Así desarrolló el modelo planetario del átomo que puso todos los protones en el núcleo y los electrones orbitados alrededor del núcleo como planetas alrededor del sol.