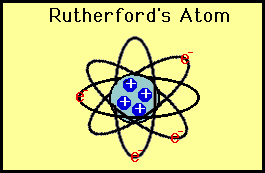
până în 1911 au fost descoperite componentele atomului. Atomul a constat din particule subatomice numite protoni și electroni. Cu toate acestea, nu a fost clar modul în care acești protoni și electroni au fost aranjați în atom. J. J. Thomson a sugerat modelul „budinca de prune”. În acest model, electronii și protonii sunt uniform amestecate de-a lungul atom:

Rutherford testat ipoteza lui Thomson, prin conceperea lui „foita de aur” experiment., Rutherford a motivat că, dacă modelul lui Thomson era corect, atunci masa atomului era răspândită în tot Atomul. Apoi, dacă a împușcat particule alfa de mare viteză (nuclee de heliu) la un atom, atunci ar fi foarte puțin pentru a devia particulele alfa. El a decis să testeze acest lucru cu un film subțire de atomi de aur. Așa cum era de așteptat, majoritatea particulelor alfa au trecut prin folia de aur, dar spre uimirea lui, câteva particule alfa au revenit aproape direct înapoi.
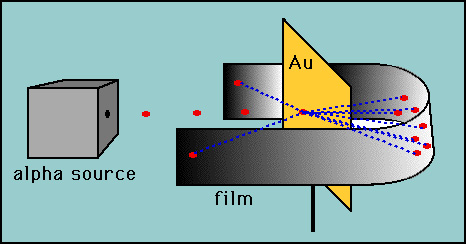
Aceste devieri nu au fost în concordanță cu Thomson model., Rutherford a fost forțat să renunțe la modelul de budincă de prune și a motivat că singura modalitate prin care particulele alfa ar putea fi deviate înapoi a fost dacă cea mai mare parte a masei dintr-un atom ar fi concentrată într-un nucleu. El a dezvoltat astfel modelul planetar al atomului care a pus toți protonii în nucleu și electronii orbitați în jurul nucleului ca planetele din jurul Soarelui.