Prezentare generală
β-oxidarea acizilor grași este un proces în mai multe etape prin care acizii grași sunt defalcați de diferite țesuturi pentru a produce energie. Acizii grași intră în principal într-o celulă prin transportorii de proteine ale acizilor grași de pe suprafața celulei . Acid gras transportatorii includ acizi grași translocase (FAT/CD36), specifice de țesut gras acid proteinele de transport (FATP), și membranei plasmatice legat fatty acid binding protein (FABPpm) . Odată ajuns în interiorul celulei, o grupare CoA este adăugată la acidul gras prin sintază acil-CoA grasă (FACS), formând acil-CoA cu lanț lung., Carnitina palmitoyltransferase 1 (CPT1) conversie de lanț lung-acil-CoA cu lanț lung acylcarnitine permite acizilor grași din molecula pentru a fi transportate prin membrana mitocondrială interior prin carnitina translocase (CAT), care schimburile cu lanț lung acylcarnitines de carnitina. O membrană mitocondrială interioară CPT2 transformă apoi acilcarnitina cu lanț lung înapoi în acil-CoA cu lanț lung. Acil-CoA cu catenă lungă intră pe calea β-oxidării acidului gras, ceea ce duce la producerea unui acetil-CoA din fiecare ciclu de β-oxidare a acidului gras., Acest acetil-CoA intră apoi în ciclul acidului tricarboxilic mitocondrial (TCA). NADH și FADH2 produse atât de β-oxidarea acidului gras, cât și de ciclul TCA sunt utilizate de lanțul de transport al electronilor pentru a produce ATP. O prezentare generală a oxidării acizilor grași este prezentată în Figura 1.
Figura 1. Oxidarea acizilor grași Prezentare generală
β-oxidarea acizilor grași este procesul prin care acizii grași sunt defalcați pentru a produce energie. Acizii grași intră în principal într-o celulă prin transportorii de proteine ale acizilor grași de pe suprafața celulei., Odată ajuns în interior, FACS adaugă un grup CoA la acidul gras. CPT1 transformă apoi acil-CoA cu lanț lung în acilcarnitină cu lanț lung. Partea de acizi grași este transportată de pisică prin membrana mitocondrială interioară. CPT2 transformă apoi acilcarnitina cu lanț lung înapoi în acil-CoA cu lanț lung. Acil-CoA cu catenă lungă poate intra apoi în calea β-oxidării acidului gras, rezultând producerea unui acetil-CoA din fiecare ciclu de β-oxidare. Acest acetil-CoA intră apoi în ciclul TCA., NADH și FADH2 produse atât de β-oxidare și ciclul TCA sunt utilizate de către lanțul de transport de electroni pentru a produce ATP.
Rol de Acid Gras de Aprovizionare în Reglementarea Grași Acid β-Oxidare
Celular acid gras de transport:
Nu a fost un efort considerabil în ultimii ani, pentru a elucida mecanismele prin care acizii grași sunt preluate de celule, în special a determina dacă acizii grași sunt transportate prin membrana celulară prin simplă difuziune sau dacă acest transport este facilitat de membrană asociate cu proteine., În timp ce diverse rezultate susțin ambele metode de transport, transportul prin proteine asociate membranei este considerat a fi mijlocul predominant de absorbție a acizilor grași în celule . Au fost identificate diferite proteine membranare care facilitează absorbția celulară a acizilor grași. Membrana asociate acizilor grași transportatorii CD36/FAT, FABPpm, și FATPs diferă în funcție de greutatea moleculară și de gradul de post-translaționale modificare . Stremmel și colab. a raportat că anticorpii direcționați împotriva FABPpm ficatului de șobolan inhibă absorbția acizilor grași de către hepatocite, adipocite și cardiomiocite cu 50-75%., Acest rezultat a sugerat că o parte semnificativă a absorbției de acizi grași depinde de transportul mediat de proteine în diferite tipuri de celule .Schaffer și LODISH au descoperit FATP prin utilizarea unei strategii de clonare a expresiei în adipocite . Expresia acestei proteine cu membrană integrală 63 kDa într-o linie stabilă de celule fibroblaste a dus la o creștere de 3-4 ori a transportului de acizi grași cu lanț lung. Identificarea acestui prim FATP a condus la descoperirea mai multor alte izoforme de FATP (FATP1-6) . FATP1 este exprimat predominant în inimă și mușchii scheletici ., FATP2 și FATP5 sunt exprimate în principal în ficat, unde sunt implicate în metabolismul lipidic hepatic în asociere cu sintetaza acil-CoA. FATP4 este esențial pentru absorbția lipidelor dietetice și are un rol critic în structura și funcția normală a pielii. Până în prezent, s-a dovedit că FATP3 și FATP6 au o funcție mică sau deloc de transport al acizilor grași .rolul proteinei membranare CD36/grăsime în absorbția acizilor grași și β-oxidarea la mamifere a fost studiat extensiv., CD36/GRĂSIME este un 88 kDa acid gras translocase membrana de proteine exprimate în funcție de rata de oxidare a acizilor grași în țesutul muscular (de exemplu, se exprimă mai mult în inimă decât în mușchii scheletici) . CD36 / grăsime este implicată în angiogeneză și inflamație, precum și în metabolismul lipidic. Transfecția fibroblastelor cu CD36 / grăsime a dus la creșterea ratelor de absorbție a acizilor grași . Spre deosebire de FATP, CD36/GRĂSIME are capacitatea de a transloca între intracelulare endosomes și membrana plasmatică a celulelor, care permite CD36/GRĂSIME pentru a juca un rol critic în acizi grași absorbție regulament., Insulina și contracția musculară pot stimula translocarea CD36 / grăsime din depozitele intracelulare în membrana plasmatică, ceea ce duce la o absorbție sporită și la β-oxidarea acizilor grași. Activarea FoxO1 poate duce la translocarea CD36/grăsime, ceea ce duce la creșterea β-oxidării acidului gras împreună cu acumularea de triacilglicerol . Acest lucru sugerează un rol semnificativ al semnalizării intracelulare în funcția CD36 / FAT.mecanismul exact care induce translocarea CD36 / FAT este încă necunoscut., Cu toate acestea, se presupune că activarea protein kinazei activate de AMP (AMPK) și starea energetică a celulelor musculare pot participa la răspunsul de translocare CD36/grăsime . Mai mult, stimularea protein kinazei C (PKC) în cardiomiocite induce translocarea CD36/grăsime, indicând un posibil rol pentru calciu în procesul de translocare . Pe de altă parte, inhibarea kinazei receptorului de semnalizare extracelular (ERK) poate bloca contracția musculară indusă de translocarea CD36/grăsime ., Post-translaționale modificarea CD36/GRĂSIME prin ubiquitination poate reglementa, de asemenea, de proteine intracelulare niveluri de CD36/GRĂSIME de direcționare proteine de degradare. Prin urmare, insulina crește disponibilitatea CD36/lipidelor pentru translocare prin inhibarea ubicuității. Cu toate acestea, acizii grași promovează ubicuitatea, ceea ce duce la degradarea CD36/grăsime .esterificarea acizilor grași în acil-CoA:
un acid gras trebuie transformat în acil-CoA gras pentru ca acesta să intre în mitocondrii și să fie oxidat ., Enzima responsabilă de esterificarea acizilor grași la acil-CoA cu lanț lung este FACS. Pentru această reacție, FACS consumă echivalentul a două ATP. O altă enzimă, tioesteraza citosolică (CTE), poate elimina CoA transformând acil-CoA gras înapoi într-un acid gras. Grăsimea acil-CoA poate fi transformată în acil carnitină, permițându-i să fie transportată în mitocondrii și să intre în β-oxidarea acidului gras sau să fie transformată în metaboliți lipidici (triacilglicerol, diacilglicerol, ceramidă etc.).,acetil-CoA carboxilaza, decarboxilaza malonil-CoA, axa malonil-CoA:
acetil-CoA carboxilaza (ACC) este o enzimă centrală implicată în β-oxidarea acizilor grași și biosinteza acizilor grași. ACC catalizează carboxilarea acetil-CoA care produce malonil-CoA, care poate fi utilizată de sintetaza acizilor grași pentru biosinteza acizilor grași . În timp ce malonil-CoA este utilizat ca substrat pentru biosinteza acizilor grași, malonil-CoA este, de asemenea, un inhibitor puternic al absorbției de acizi grași mitocondriali secundar inhibării CPT1 (Figura 2) ., Există două forme de ACC, o 265 kDa ACC1 izoenzimei, care este puternic exprimată în ficat și țesutul adipos, și un 280 kDa ACC2 izoenzima care este mult mai specific extrem de organe metabolice, cum ar fi mușchii scheletici și inima . AMPK joacă un rol major în reglarea ACC1 și ACC2 prin fosforilarea și inhibarea activității ACC. În situații de cerere crescută de energie, AMPK este activat, unde apoi fosforilează și inactivează ambele izoforme ale ACC (Figura 3). ACC2 inhibarea poate duce la o creștere în acizi grași β-oxidare, în timp ce biosinteza acizilor grași scade atunci când ACC1 este inhibată .,
Figura 2. Grași acid β-oxidare cale
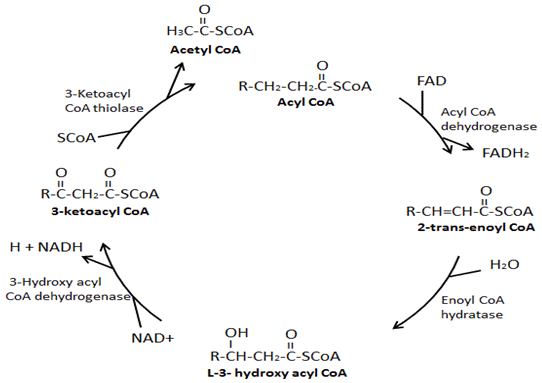
principalele patru enzime implicate în β-oxidare sunt: acil-CoA dehidrogenaza, enoil-CoA hydratase, hidroxi acil-CoA dehidrogenaza, și ketoacyl-CoA thiolase. Acil-CoA dehidrogenaza creează o legătură dublă între al doilea și al treilea Carboni în jos din gruparea CoA pe acil-CoA și în proces produce un FADH2., În continuare, hidrataza enoil-CoA îndepărtează legătura dublă formată, în procesul de adăugare a unei grupări hidroxil la al treilea carbon în jos din gruparea CoA și un hidrogen pe al doilea carbon în jos din gruparea CoA. Hidroxiacil – CoA dehidrogenaza elimină hidrogenul din gruparea hidroxil doar atașat și în procesul produce o NADH. În etapa finală, ketoacyl-CoA thiolase acordă o CoA grup pe cel de-al treilea carbon în jos din partea de CoA grup care rezultă în formarea a două molecule, o acetil-CoA și o acil-CoA, care este de doi atomi de carbon mai scurt.,
reglarea pe termen lung a ACC depinde de reglarea expresiei sale genetice. Mai multe factorilor transcripționali poate reglementa ACC expresia genelor, inclusiv sterol regulatory element de legare de proteine (SREBP1a și SREBP1c) și carbohidrați response element binding protein (ChREBP) . Srebp este reglat de insulină, care promovează reticulul endoplasmatic SREBP1c să fie scindat și translocat în nucleu, ceea ce duce la stimularea expresiei ACC., Mai mult decât atât, factorii de transcripție peroxisome proliferator activated receptor γ coactivator 1 (PGC-1) α și β pot stimula expresia SREBP1a și SREBP1c, ambele din care au un rol vital în lipogeneza. Expresia ChREBP poate fi indusă de concentrații ridicate de glucoză, rezultând ChREBP activat care promovează expresia acc1 și sintaza acizilor grași . Factorul respirator Nuclear-1 (NRF-1) este un modulator principal al expresiei proteinei mitocondriale și al biogenezei mitocondriale, ambele fiind importante pentru o capacitate mai mare de β-oxidare a acidului gras mitocondrial ., De exemplu, Adam și colab. a arătat că supraexpresia NRF-1 are ca rezultat inhibarea activității promotorului genei ACC2 în inima mamiferelor, ceea ce sporește ratele de β-oxidare a acidului gras mitocondrial, promovând astfel capacitatea energetică intracelulară globală .
decarboxilaza Malonil-CoA (MCD) este enzima responsabilă de decarboxilarea malonil-CoA la acetil-CoA . În general, nivelul malonil-CoA este scăzut atunci când activitatea MCD este crescută, rezultând o rată crescută de oxidare a acizilor grași., S-a raportat că protein kinazele care fosforilează și inhibă ACC ar putea activa MCD . Cu toate acestea, MCD pare să fie reglementată în primul rând prin mijloace transcripționale (discutate mai târziu). Prin urmare, MCD și ACC par să lucreze în armonie pentru a regla piscina de malonil-CoA care poate inhiba CPT1 .mitocondrial carnitină palmitoil transferază (CPT):
izoforma CPT, CPT1, se află pe suprafața interioară a membranei mitocondriale exterioare și este un situs major de reglare a absorbției de acid gras mitocondrial ., După cum sa menționat, cpt1 este puternic inhibat de malonil-CoA, produsul ACC care se leagă de partea citosolică a CPT1. Mamiferele exprimă trei izoforme de CPT1, care sunt codificate de gene diferite. Ficatul izoenzimei (CPT1a), mușchiul izoenzimei (CPT1ß), și un al treilea izoforma CPT1 (CPT1c), care este exprimată, în primul rând în creier și testicul . Mai exact, inima își exprimă două izoforme de CPT1, 82 KDa (CPT1a) izoenzimei și predominant 88 KDa (CPT1ß) izoenzima (care are cea mai mare sensibilitate la malonil-CoA inhibiție)., Insulina și hormonul tiroidian pot regla sensibilitatea cpt1a în ficat; cu toate acestea, izoforma CPT1ß nu este afectată . Studiile anterioare au raportat că nivelurile de malonil-CoA sunt invers corelate cu ratele de β-oxidare a acizilor grași . În plus, studiile pe ACC2 knock-out șoareci sugerează două celulare distincte malonil-CoA piscine, malonil-CoA produs de ACC1 (utilizate în principal pentru lipogeneza), și un citosolic piscină de malonil-CoA produs de ACC2 implicat în regulamentul de CPT1 grași și acid β-oxidare .,
β-oxidarea acidului gras mitocondrial
calea de β-oxidare a acidului gras:
β-oxidarea acidului gras este procesul de descompunere a unei molecule de acil-CoA cu lanț lung la moleculele de acetil-CoA. Numărul de acetil-CoA produs depinde de lungimea de carbon a acidului gras fiind oxidat. Acest proces implică o varietate de enzime, cu patru principalele enzime implicate în acizi grași β-oxidare fiind, în ordine, acil-CoA dehidrogenaza, enoil-CoA hydratase, hydroxyacyl-CoA dehidrogenaza, și ketoacyl-CoA thiolase (Figura 3) ., La sfârșitul fiecărui ciclu de β-oxidare, se formează două molecule noi, un acetil-CoA și un acil-CoA care este cu doi atomi de carbon mai scurt. În plus, în timpul β-oxidării se formează NADH și FADH2. Un FADH2 este produs în timpul reacției catalizate de acil-CoA dehidrogenază. Un NADH este produs în timpul reacției catalizate de hidroxiacil-CoA dehidrogenază. FADH2 și NADH produse în timpul procesului de β-oxidare a acidului gras sunt utilizate de lanțul de transport al electronilor pentru a produce ATP., Există diferite izoforme ale acestor enzime de β-oxidare, care au afinități diferite pentru diferite lungimi ale lanțului de acizi grași. De exemplu, există o acil-CoA dehidrogenază cu lanț foarte lung, o acil-CoA dehidrogenază cu lanț lung, o acil-CoA dehidrogenază cu lanț mediu și o acil-CoA dehidrogenază cu lanț scurt. Interesant este că hidrataza enoil-CoA, hidroxiacil-CoA dehidrogenaza și izoformele cetoacil-CoA specifice acizilor grași cu lanț lung formează un complex enzimatic pe membrana mitocondrială interioară.
Figura 3., Principalele site-uri de reglementare a acidului gras β-oxidare
acid gras β-oxidare este reglată la mai multe niveluri. Această cifră arată câteva dintre modalitățile de reglementare a β-oxidării acidului gras. 1. Reglarea poate apărea la nivelul intrării acizilor grași în celulă. AMPK, PKC și PPARy reglează pozitiv activitatea CD36 / FATP. 2. Reglementarea are loc și prin reglarea nivelurilor de acetil-CoA și malonil-CoA. AMPK inhibă ACC, rezultând niveluri crescute de acetil-CoA / niveluri scăzute de malonil-CoA și oxidare crescută a acizilor grași. Malonil-CoA inhibă oxidarea acizilor grași prin inhibarea CPT1., 3. Reglementarea transcripțională este, de asemenea, implicată în reglarea β-oxidării acizilor grași. PGC-1α, un coregulator al factorului de transcripție și factorul de transcripție PPARa acționează în nucleu pentru a crește transcripția genelor mitocondriale, a genelor de utilizare a acizilor grași și a altor factori de transcripție.
enzimele auxiliare sunt necesare pentru β-oxidarea acizilor grași nesaturați și a acizilor grași cu catenă impară. Acizii grași cu numere impare sunt defalcați prin β-oxidare în molecule de acetil-CoA și propionil-CoA., În timp ce propionil-CoA poate fi metabolizat prin căi alternative, este metabolizat în principal în celula de la succinil-CoA de trei enzime (propionil-CoA carboxilaza, methylmalonyl-CoA epimerază, și methylmalonyl-CoA mutase) . Acest succinil-CoA poate intra apoi în ciclul TCA. În comparație cu acizii grași cu număr par, acizii grași cu număr impar apar rar în natură . Cele două enzime auxiliare, izomeraza enoil-CoA și 2,4-dienoil-CoA reductaza sunt necesare pentru oxidarea completă a acizilor grași nesaturați ., În β-oxidare ciclu în care csi-legătură dublă începe în a treia carbon de acil-CoA, primul pas implică enoil-CoA izomeraza isomerizing înainte de enoil-CoA hydratase, și alte două enzime, poate acționa pe acil-CoA. O legătură dublă pe un carbon cu număr egal necesită atât enzimele auxiliare. Odată ce legătura dublă se află pe cel de-al patrulea carbon al acil-CoA la începutul unui ciclu de β-oxidare, începe să fie oxidată. În urma acțiunii acil-CoA dehidrogenazei, 2,4-dienoil CoA reductaza acționează asupra acil-CoA urmată de izomeraza enoil-CoA., Hidrataza enoil-CoA acționează apoi asupra acil-CoA și procesul își reia ordinea normală.
controlul alosteric al β-oxidării acidului gras:
activitatea enzimelor β-oxidării acidului gras este afectată de nivelul produselor reacțiilor lor . Fiecare dintre enzimele β-oxidare este inhibată de intermediarul acil-CoA gras specific pe care îl produce . Interesant este că 3-cetoacil-CoA poate inhiba, de asemenea, hidrataza enoil-CoA și acil-CoA dehidrogenaza . β-oxidarea poate fi, de asemenea, reglată alosteric prin raportul dintre nivelul NADH/NAD+ și nivelul acetil-CoA/CoA., O creștere a raporturilor NADH/NAD+ sau acetil-CoA/CoA are ca rezultat inhibarea β-oxidării acidului gras. S-a demonstrat în mod specific că creșterile raportului acetil-CoA/CoA conduc la inhibarea feedback-ului cetoacil-CoA tiolazei .
β-oxidarea acidului gras poate apărea și în peroxizomi. La animale, peroxizomii sunt considerați a fi importanți în defalcarea inițială a acizilor grași cu catenă foarte lungă și a acizilor grași ramificați de metil . Enzimele implicate în oxidarea acizilor grași în peroxizomi sunt diferite de mitocondrii., O diferență importantă este acil-CoA oxidaza, prima enzimă din peroxizomul β-oxidare, care transferă hidrogenul în oxigenul care produce H2O2 în loc să producă FADH2. H2O2 este defalcat în apă de catalază. Foarte important, intermediarii grași acil-CoA formați în timpul β-oxidării sunt aceiași în peroxizomi și mitocondrii. Peroxizomii conțin, de asemenea, enzimele necesare pentru α-oxidare, care sunt necesare pentru oxidarea unor acizi grași cu ramuri de metil.,
transcriptionala a grași acid β-oxidare:
proteinele implicate în acizi grași β-oxidare sunt reglementate de ambele transcripțional și post-transcripțional mecanisme. Există o serie de factori de transcripție care reglează expresia acestor proteine. Receptorii activați de proliferarea peroxizomilor (PPAR) și coactivatorul factorului de transcripție PGC-1α sunt cei mai cunoscuți regulatori transcripționali ai β-oxidării acizilor grași . PPAR și receptorul Retinoid X heterodimerizează și se leagă de promotorii genei care conțin elementul de răspuns PPAR ., Exemple de proteine implicate în acizi grași β-oxidare care sunt transcriptionally reglementate de Ppar includ FATP, acil-CoA sintetaza (ACS), CD36/FAT, MCD, CPT1, cu lanț lung acil-CoA dehidrogenaza (LCAD), și cu lanț mediu acil-CoA dehidrogenaza (DPIC) . Receptorul α (ERRa) legat de Estrogen a fost, de asemenea, implicat în reglarea β-oxidării acidului gras, fiind demonstrat că reglează și transcripția genei care codifică MCAD . Liganzii care se leagă și modulează activitatea PPARa, δ și γ includ acizi grași .,
genele reglementate de fiecare dintre PPAR variază între tipurile de țesuturi. De exemplu, mușchiul scheletic PPARδ, dar nu PPARa, reglează expresia CPT1 . Izoformele PPAR sunt, de asemenea, exprimate diferențiat între tipurile de țesuturi . În timp ce proteina PPARδ tinde să fie exprimată omniprezent, PPARa este exprimată predominant în țesuturi extrem de metabolice (adică inimă, mușchi scheletici și ficat), iar PPARy este exprimată predominant în țesuturi, cum ar fi țesutul adipos . Până de curând, nu se credea că PPARy joacă un rol semnificativ în reglarea β-oxidării acizilor grași., Cu toate acestea, studiile recente de knockout și supraexpresie au sugerat că PPARy poate avea un rol în reglarea β-oxidării acizilor grași. Supraexprimarea PPARy în mușchiul cardiac duce la creșterea valorilor ARNm pentru proteinele β-oxidante ale acizilor grași .co-activatorul transcripțional PGC-1α se leagă și crește activitatea PPAR și ERRa pentru a regla β-oxidarea acidului gras . PGC-1α modulează activitatea unui număr de factori de transcripție care pot crește expresia proteinelor implicate în β-oxidarea acidului gras, ciclul TCA și lanțul de transport al electronilor., De exemplu, creșterea expresiei proteinei PGC-1α induce biogeneza mitocondrială masivă în mușchiul scheletic .PGC-1α este reglată atât la nivelul genei, cât și la nivelul proteinei. AMPK crește activitatea proteinei PGC-1α preexistente prin două mecanisme propuse. Primul este prin fosforilarea PGC-1α asupra reziduurilor de treonină și serină, rezultând o creștere generală a activității PGC-1α . AMPK poate crește, de asemenea, activitatea PGC-1α prin activarea sirtuin 1 (SIRT1). SIRT1 poate apoi deacetilat PGC-1α, crescând activitatea sa ., Se crede că AMPK crește nivelurile ARNm PGC-1α prin reglarea legării factorilor de transcripție la secvențe specifice situate în promotorul genei PGC-1α, care includ două situsuri MEF, un situs al elementului de răspuns cAMP (CRE) și regiunea GATA/Ebox . AMPK reglează situsurile MEF prin fosforilarea GEF, o proteină care poate Media mișcarea MEF2 în nucleu . AMPK poate crește legarea de situsul CRE prin fosforilarea proteinei de legare a elementului de răspuns cAMP (CREB) 1 și a altor membri ai familiei CREB care se leagă de regiunile promotorului CRE ., Ca un alt exemplu, acizii grași liberi pot regla, de asemenea, expresia proteinei PGC-1α. De exemplu, o dietă bogată în grăsimi poate ridica nivelurile de PGC-1α în mușchiul scheletului de șobolan .
concluzii
β-oxidarea acidului gras este calea metabolică majoră care este responsabilă de descompunerea mitocondrială a acil-CoA cu lanț lung la acetil-CoA. Acest proces implică multe etape care sunt reglementate la nivel transcripțional și post-transcripțional., Reglementarea transcripțională implică PPAR, SREBP1 și PGC-1α, în timp ce nivelul post-transcripțional implică în principal controlul alosteric al oxidării β a acizilor grași, precum și reglementarea ACC, MCD și CPT. Ambele mecanisme funcționează în armonie pentru a asigura o aprovizionare continuă de acil-CoA cu lanț lung pentru β-oxidare și produse de β-oxidare pentru producerea de energie mitocondrială.
mulțumiri: GDL este un om de știință al Fundației Alberta Heritage pentru Cercetare Medicală