By 1911 the components of the atom had been discovered. O átomo consistia em partículas subatômicas chamadas prótons e elétrons. No entanto, não ficou claro como esses prótons e elétrons foram dispostos dentro do átomo. J. J. Thomson sugeriu o modelo de pudim de ameixa. Neste modelo, os elétrons e os prótons são uniformemente misturadas através de todo o átomo:

Rutherford testado Thomson, de hipótese, elaboração de sua “folha de ouro” da experiência., Rutherford argumentou que se o modelo de Thomson estava correto, então a massa do átomo foi espalhada por todo o átomo. Então, se ele atirou partículas alfa de alta velocidade (núcleos de hélio) em um átomo, então haveria muito pouco para desviar as partículas alfa. Ele decidiu testar isso com uma fina película de átomos de ouro. Como esperado, a maioria das partículas alfa atravessou a folha de ouro, mas para seu espanto algumas partículas alfa se recuperaram quase diretamente para trás.
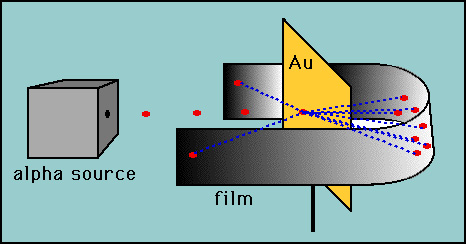
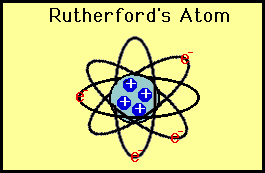
estas deflexões não eram consistentes com o modelo de Thomson., Rutherford foi forçado a descartar o modelo de Pudim de ameixa e argumentou que a única maneira de as partículas alfa serem desviadas para trás era se a maior parte da massa de um átomo estivesse concentrada num núcleo. Ele assim desenvolveu o modelo planetário do átomo que colocou todos os prótons no núcleo e os elétrons orbitados ao redor do núcleo como planetas ao redor do sol.