carga Formal e estrutura de Lewis
ligações covalentes em uma molécula e a carga geral de uma molécula pode ser visualizada com estruturas de pontos de Lewis.
objectivos de aprendizagem
calcular cargas formais sobre os átomos num composto
Takeaways chave
pontos-chave
- estruturas de Lewis, também chamadas diagramas de pontos de Lewis, ligação covalente modelo entre átomos. Estes diagramas usam pontos em torno de átomos para significar elétrons e linhas para significar ligações entre átomos.,estruturas de Lewis incorporam a carga formal de um átomo, que é a carga de um átomo em uma molécula, assumindo que elétrons em uma ligação química são compartilhados igualmente entre átomos.quando múltiplas estruturas de Lewis podem representar o mesmo composto, as diferentes fórmulas de Lewis são chamadas de estruturas de ressonância.
termos-chave
- carga formal: a carga atribuída a um átomo numa molécula, assumindo que os electrões numa ligação química são partilhados igualmente entre átomos. Isto ajuda a determinar qual das poucas estruturas de Lewis é mais correta.,regra dos octetos: os átomos perdem, ganham ou compartilham elétrons a fim de ter uma camada de Valência completa de oito elétrons.estrutura de ressonância: uma molécula ou íon poliatômico que tem múltiplas estruturas de Lewis porque a ligação pode ser mostrada de várias maneiras.
estruturas de Lewis
representações pictóricas são frequentemente usadas para visualizar elétrons, bem como qualquer ligação que pode ocorrer entre átomos em uma molécula. In particular, chemists use Lewis structures (also known as Lewis dot diagrams, electron dot diagrams, or electron structures) to represent covalent compounds., Nestes diagramas, os elétrons de Valência são mostrados como pontos que se sentam ao redor do átomo; quaisquer ligações que os átomos compartilham são representadas por linhas simples, duplas ou triplas.

The Lewis dot structure of carbon: a typical Lewis structure of carbon, with the valence electrons denoted as dots around the atom.
geralmente, a maioria das estruturas de Lewis seguem a Regra do octeto; elas irão compartilhar elétrons até atingir 8 elétrons em sua concha de Valência., No entanto, há exceções à regra dos octetos, como o boro, que é estável com apenas 6 elétrons em sua concha de Valência. Os elementos hidrogênio (H) e hélio (He) seguem a Regra do dueto, que diz que sua concha externa de Valência está cheia de 2 elétrons.
desenhando uma estrutura de Lewis
para desenhar uma estrutura de Lewis, o número de elétrons de Valência em cada átomo do composto deve ser determinado. O número total de elétrons de Valência em todo o composto é igual à soma dos elétrons de valência de cada átomo no composto., Elétrons de não-Valência não são representados ao desenhar as estruturas de Lewis.elétrons de Valência são colocados como pares isolados (dois elétrons) em torno de cada átomo. A maioria dos átomos pode ter um octeto incompleto de elétrons. No entanto, os átomos podem compartilhar elétrons uns com os outros para cumprir esta exigência de octetos. Uma ligação que compartilha dois elétrons é chamada de uma única ligação e é significada por uma reta, linha horizontal.se a Regra do octeto ainda não estiver satisfeita, os átomos podem formar uma ligação dupla (4 elétrons compartilhados) ou tripla (6 elétrons compartilhados)., Como o par de ligação é compartilhado, o átomo que tinha o par solitário ainda tem um octeto, e o outro átomo ganha dois ou mais elétrons em sua concha de Valência.por exemplo, o CO2 é uma molécula neutra com 16 elétrons de Valência total. Na estrutura de Lewis, o carbono deve estar ligado a ambos os átomos de oxigénio.

The Lewis structure for carbon dioxide: This diagram shows the conceptual stages of drawing the Lewis structure for a molecule of carbon dioxide (CO2).
estruturas de Lewis também podem ser desenhadas para íons., Nestes casos, toda a estrutura é colocada entre parênteses, e a carga é escrita como um sobrescrito na parte superior direita, fora do suporte.

The Lewis structure for the hydroxide ion: In the hydroxide ion (OH -), the entire structure is surrounded by a bracket, and the charge is placed outside the bracket.
determinando carga Formal
embora saibamos quantos elétrons de Valência estão presentes num composto, é mais difícil determinar em torno de quais átomos os elétrons realmente residem., Para ajudar com este problema, os químicos frequentemente calculam a carga formal de cada átomo. A carga formal é a carga elétrica que um átomo teria se todos os elétrons fossem compartilhados igualmente.
A carga formal de um átomo pode ser determinado pela seguinte fórmula:
FC = V – (N + \frac{B}{2})
nesta fórmula, V representa o número de elétrons de valência do átomo isoladamente, N é o número de não-ligação de valência elétrons, e B é o número total de elétrons em ligações covalentes com outros átomos na molécula.,
Por exemplo, vamos calcular a carga formal em um átomo de oxigénio em dióxido de carbono (CO2) molécula:
FC = 6 elétrons de valência – (4 non-ligação de valência elétrons + 4/2 elétrons em ligações covalentes)
FC = 6 – 6 = 0
O átomo de oxigénio em dióxido de carbono tem um formal de carga de 0.
estruturas de ressonância
às vezes múltiplas estruturas de Lewis podem ser desenhadas para representar o mesmo composto. Estas estruturas equivalentes são conhecidas como estruturas de ressonância e envolvem o deslocamento de elétrons e não de átomos reais., Dependendo do composto, o deslocamento de elétrons pode causar uma mudança nas cargas formais. Na maioria das vezes, as estruturas de Lewis são desenhadas para que a carga formal de cada átomo seja minimizada.
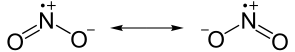
estruturas de ressonância: duas das estruturas que contribuem para o dióxido de azoto (NO2). Ambas as fórmulas representam o mesmo número de átomos e elétrons, apenas em uma conformação ligeiramente diferente.