algumas espécies de Anolis apresentam dimorfismo trófico, que pode envolver a identidade do item (Rodríguez 2010), a quantidade de presas, frequência e volume (Perry 1996). Nestes casos, as diferenças podem estar relacionadas com o dimorfismo do tamanho sexual (tamanho do corpo e dimensões da cabeça) (Schoener 1968), comportamento de procura de alimentos (relacionado com diferenças nos papéis sexuais masculinos e femininos) (Butler e Losos 2002, Butler et al., 2007, Perry 1996, Steffen 2009, Vincent and Herrel 2007), variation in perch use (Perry 1996, Schoener 1967), population density (Stamps et al. 1997), ou diferenças nas necessidades energéticas durante a época de reprodução (Schoener 1968, Vitt e Zani 1998).
dietas de anóis variam entre e dentro das espécies, e pelo menos alguma desta variação parece relacionada com diferenças no uso de recursos estruturais (tipo de poleiro e altura) e o acesso relacionado, e abundância de presas diferentes (Fleming e Hooker 1975, Vitt e Zani 1998, Vitt et al. 2002, 2003b)., Dentro da variação de espécies na ecologia de alimentação tem sido registrado em anóis Amazônicos como A. trachyderma (Vitt et al. = = Ligações externas = = * site oficial 2003a), e A. fuscoauratus (Vitt et al. 2003b).
Geográfica variação de fatores tais como competitivos, interações interespecíficas, presa a disponibilidade, estruturais e de uso de recursos tem sido sugerida como a causa subjacente de variação intraespecífica em hábitos alimentares dessas espécies (Fleming e Putaria 1975, Gutiérrez e Rumiz 2002, Régnière De 2009, Rodríguez 2010, Schoener 1968) e lagartos em geral (Aun et al. 1999).,Anolis ventrimaculatus Boulenger 1911 é uma espécie de planta com flor pertencente à família Asteraceae. Esta espécie exibe dimorfismo de tamanho sexual e forma corporal, que também varia entre as localidades (Calderón-Espinosa et al. 2013). O dimorfismo nesses traços sugere diferenças no uso de recursos entre os sexos e possivelmente, pelo menos alguma variação entre as populações. Avaliamos esta hipótese descrevendo as dietas de machos e fêmeas em diferentes localidades dentro da área de distribuição da espécie.,materiais e métodos
medimos o comprimento do orifício de focinho (SVL) de cada indivíduo com um paquímetro digital até 0,1 mm e removemos estômagos e porções proximais de intestinos. Estômagos e conteúdo intestinal foram identificados para ordem e família, quando possível, após Triplehorn e Johnson (2005). Nós então estimamos o número de presas usando cabeças, asas, pernas, antenas e outras partes do corpo identificáveis. Como o preys foi parcialmente digerido, não conseguimos estimar o tamanho da presa. Subsequentemente, neste artigo, “item” refere-se à identidade taxonómica (por exemplo,,, Orthoptera, Coleoptera), enquanto “prey” refere-se a presas individuais ingeridas por lagartos.análises de dados. Avaliamos o dimorfismo dietético em espécies e níveis de localidade comparando o número e a frequência de itens observados (aqueles identificados ao nível da ordem) entre os sexos usando testes qui quadrados. O número de presas foi comparado por testes t, depois de avaliar qualquer relação com a SVL lagarto usando testes de correlação Spearman (Zaar 1990). Também analisamos as porcentagens de uso de itens que representavam > 70% da ingesta, e usamos o teste t para compará-los entre os sexos., O uso de presas foi derivado do número de preys por item por número individual/total de presas ingeridas por cada indivíduo.
também analisámos a variação geográfica usando ANOVA e um teste Tukey a posteriori para comparar dietas de fêmeas e machos e a percentagem de utilização de itens que representavam > 70% de ingesta nas várias localidades.
normalidade e homocedasticidade foram avaliados para todos os dados e transformados em Log10 aqueles que não atenderam a suposições. Foram realizadas análises de dados em Statistica ver. 8.0 (demo).,
largura trófica de nicho, sobreposição de nicho e índices de dominância. Nós estimamos o nicho trófico amplitude para machos e fêmeas, utilizando o inverso do índice de Simpson (1949) da seguinte maneira: B = (Σpi2)-1,
onde p representa a percentagem de utilização de item. Nós também determinou se machos e fêmeas semelhantes recursos alimentares por estimar sobreposição de nicho, como proposto por Pianka (1973):
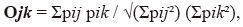
onde pij pik representa a porcentagem de uso de recurso que as mulheres, (j) e machos (k). Estes índices foram calculados utilizando software Ecosim.,finalmente, estimamos o índice de dominância Lambda (Aun et al. 1999, Montori 1988, 1991, 1992) da seguinte forma:
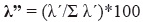
nesta equação, λ’ = λ/n*100 e λ = Σpi2,
RESULTADOS
Todos os 118 indivíduos examinados tinham alguns ingesta no estômago e o intestino proximal. Um total de 1021 presas, (593 em fêmeas e 428 em machos) foram classificadas em 16 itens no nível ordinal de insetos, arachnídeos (Araneae), miríapodes e crustáceos (isópodes estavam presentes em uma fêmea)., Hymenoptera and Coleoptera, which exhibited the highest taxonomic diversity at the familial level, were classified in 24 families. Alguns indivíduos tinham ingerido material vegetal identificado como Marchantiophyta, shed e pedras pequenas. Estes foram considerados incidentais, porque foram observados apenas em três indivíduos (Tabela 1) e presumivelmente foram ingeridos acidentalmente.,
estes lagartos alimentam-se principalmente de Coleoptera, Hymenoptera (principalmente formigas) e larvas de insetos, com Coleoptera classificada como um item primário, enquanto que Hymenoptera e larvas foram classificadas como itens secundários, e outros foram considerados, acidentais (tabela 1). A maioria dos estômagos de todas as localidades continha nemátodos parasitas não identificados.dimorfismo Sexual e dieta. Catorze itens foram observados em estômagos de cada sexo. Machos e fêmeas tinham alimentado com o mesmo número de itens (X2 = 1,37, p > 0,05). No entanto, alguns itens foram observados apenas em homens ou mulheres., Isópodes e isopterans (pequenas e, principalmente, terrestre presa) foram encontrados apenas em uma e duas fêmeas, respectivamente, enquanto que trichopterans e neuropterans (grande e principalmente arbóreas presa) estavam presentes apenas em dois machos de diferentes localidades. Apesar destas diferenças, as dietas masculinas e femininas eram muito semelhantes, como indicado pela sobreposição muito alta de nicho (0,99). = = Demografia = = = = ligações externas = =
achos e fêmeas da localidade um exibiu uma percentagem diferente de uso de ortopteranos (t = 3, 76, p = 0, 002) e himenópteros (t = 2, 44, p = 0.,02), e aqueles da localidade seis ingeriram diferentes quantidades de ortopteranos (t = 2.24, p = 0.04). Na localidade dois, só as fêmeas se alimentavam de ortopteranos. Machos e fêmeas em outras localidades não diferiam significativamente no uso destes itens.
variação geográfica. Apenas os itens que eram aparentemente exclusivos de homens ou mulheres, e presentes em frequências muito baixas e baixas porcentagens de uso exibiam variação geográfica., Isópodes foram observados apenas em uma localidade, isopterans foram encontrados em duas fêmeas na localidade de seis, trichopterans na localidade de três, neuropterans na localidade de dois, Blattodea em localidades dois e seis, miriápodes em localidades de três e seis anos, e collembolans em localidades de três e quatro (figura 1).
Machos comeram números similares de rapina em todas as localidades, mas as fêmeas não (F60, 5 = 3.56, p = 0,007), com diferenças significativas observadas entre as mulheres em uma localidade e aqueles provenientes de localidades de três, quatro e cinco (teste de Tukey, p < 0.05).,Anolis ventrimaculatus é um insectívoro, tal como a maioria das outras espécies de Anolis, incluindo a. tolimensis (Ardila-Marín et al. 2008), A. homolechis (Rodríguez 2010), A. cybotes (Fobes et al. 1992), e A. aeneus (Stamps et al. 1997). Coleoptera, Hymenoptera e larvas de insetos foram os itens mais frequentemente consumidos, provavelmente porque estes itens são mais abundantes (Fobes et al. 1992). Nossos resultados também sugerem que esta espécie pode ser considerada um generalista dietético/oportunistas que forrageia principalmente em poleiros de árvores, e raramente no terreno.,os Nematodes encontrados no estômago e no conteúdo intestinal são parasitas comuns em lagartos de Anolis (Fobes et al. 1992, Goldberg and Bursey 2002, Lenart et al. 1994). A carga parasitária pode influenciar o sucesso e o comportamento reprodutivo dos lagartos (Suzán-Azpiril et al. 2008), mas essa informação não está disponível para A. ventrimaculatus.as diferenças sexuais na dieta eram mínimas e estavam principalmente relacionadas com o número de presas, com os machos provavelmente comendo presas maiores, explicando o menor número de presas ingeridas quando comparadas com as fêmeas, e como observado em outros anóis (p. ex.,, Perry 1996, Rodríguez 2010, Schoener 1967, 1968). Embora não formalmente determinado devido à digestão parcial da ingesta, as diferenças de tamanho das presas foram sugeridas por alguns itens muito grandes encontrados apenas em machos (Montealegre 1997, Triplehorn e Johnson 2005).as diferenças menores observadas entre os sexos são semelhantes às observadas em A. trachyderma (Vitt et al. = = Referências = = = = ligações externas = = 2005)., Algumas das diferenças, como o número de presas ou porcentagem de uso de itens, podem estar relacionadas a diferenças na disponibilidade de presas atribuíveis a diferentes utilizações microhabitat estruturais entre os sexos, como sugerido pela variação no tamanho do corpo e dimorfismo da forma (Calderón-Espinosa et al. 2013). No entanto, o uso de microhabitat ou disponibilidade de presas nesta espécie não foi descrito, e as causas subjacentes às pequenas diferenças sexuais na dieta de A. ventrimaculatus permanecem desconhecidas.,
a variação geográfica observada na identidade do item dentro de machos e dentro de fêmeas pode ser explicada como um efeito de tamanho de amostra, uma vez que esta variação envolveu apenas esses itens, encontrados em frequências muito baixas em cada localidade. Estes itens foram observados na dieta de outras espécies com baixas frequências semelhantes (Ardila-Marín et al. 2008, Rodríguez 2010).o número Total de presas variava apenas entre as fêmeas de diferentes localidades., O consumo de quantidade de alimentos pode estar relacionado à condição reprodutiva dos indivíduos, uma vez que as necessidades energéticas das fêmeas gravidas são diferentes das das fêmeas não-gravidas (Andrews e Asato 1977, Lososos 2009, Rodríguez 2010). No entanto, a maioria das mulheres incluídas neste estudo eram gravidas, apenas três estavam em um estágio vitelogênico inicial e uma era pós-gravígida. Consequentemente, a variação da quantidade de alimentos ingeridos pelas fêmeas aparentemente não estava relacionada com as necessidades energéticas para o desenvolvimento folicular ou ovopinal.,além disso, flutuações sazonais na disponibilidade de presas podem afetar os hábitos alimentares destes lagartos. Densidades de insetos e outros invertebrados geralmente oscilam entre estações do ano (Régnière 2009), afetando a disponibilidade de presas para lagartos, como descrito para A. homolequis (Rodríguez, 2010), A. cupreus (Fleming e Putaria 1975), e outras espécies deste grupo (Aun et al. 1999).o nosso estudo representa um primeiro esforço para compreender os efeitos do dimorfismo do tamanho do corpo e da forma, e a variação geográfica de um anolo Andino., No entanto, são necessários dados ecológicos adicionais para explicar a pequena variação dietética observada nesta espécie.
AKNOWLEDGEMENTS
This study was made possible through access to preserved specimens stored in the Reptile Collection of the Instituto de Ciencias Naturales, UN. Agradecemos a C. Sarmiento, G. Amat, E. Flores, J. H. García, D. Martínez, e F. Fernández pela ajuda na identificação de artrópodes e J. Uribe, ajudando a identificar o conteúdo vegetal dos estômagos lagartos. Uma revisão anônima melhorou este manuscrito.
Andrews RM, Asato T. 1977., Utilização de energia de um lagarto tropical. Comparative Biochemistry and Physiology, 58A: 57-62. Boulenger GA. 1911. Descrições de novos répteis dos Andes da América do Sul, preservados no Museu Britânico. The Annals and Magazine of Natural History, 8th series, 7 (37): 19-25. Butler MA, Lososos JB. 2002. Dimorfismo sexual multivariado, seleção sexual e adaptação em lagartos Anolis das Antilhas maiores. Monografias Ecológicas, 72 (4): 541- 559. Calderón-Espinosa ML, Ortega-León A, Zamora-Abrego JG. 2013., Variation Intraspecific in body size dimensions in an Andean highland anole species (Anolis ventrimaculatus: Squamata, Dactyloidae). Revista de Biología Tropical, 61 (1): 255-262.
Eaton JM, Larimer SC, Howard KG, Powell R Parmerlee js Jr.2002. Densidades populacionais e libertação ecológica do lagarto solitário Anolis gingivinus em Anguilla, Índias Ocidentais. Caribbean Journal of Science, 38 (1): 27-36.
Gutiérrez T, Rumiz D. 2002. Patrones de diversidad de grupos selecionados de insetos en el bosque chiquitano y pampas del cerrado de Santiago y Tucavaca, Santa Cruz, Bolívia., Revista Boliviana de Ecología, 11 (1): 37-46. Henderson EW, Powell r. 2009. Natural history of West Indian reptiles and amphibians. Gainesville( Florida): University of Florida Press. P. 495. Lenart LA, Powell R, Parmelee js Jr, Smith DD, Lathrop a. 1994. Dieta e um parasita gástrico de Anolis armouri, um anolo cybotóide de pinhais de montanha no sul de Hispaniola. Herpetological Natural History, 2 (1): 97-100.
Perry G. 1996., The evolution of sexual dimorphism in the lizard Anolis polylepis( Iguania): evidence from intraspecific variation in foraging behavior and diet. Canadian Journal of Zoology, 74 (7): 1238-1245. Pianka ER. 1973. The structure of lizard communities. Annual Review of Ecology and Systematics, 4: 53-74.
Régnière J. 2009. Predicción de la distribución continental de insectos a partir de la fisciología de las especies. Unasylva, 60 (1): 231-232. Schoener TW. 1967. The ecological significance of sexual dimorphism in size in the lizard Anolis conspersus., Science, 155 (3761): 474-477. Simpson EH. 1949. Medição da diversidade. Nature, 163: 688. Stamps JA, Losos JB, Andrews RM. 1997. A comparative study of population density and sexual size dimorphism in lizards. The American Naturalist, 149 (1): 126-135. Steffen JE. 2009. An assessment of allometry for sexual size dimorphism in mainland anoles. South American Journal of Herpetology, 4 (3): 245-252. Suzán-Azpiril G, Galindo-Maldonado F, Ceballos-González G. 2008. La importancia del estudio de enfermidades en la conservación de la fauna silvestre., Veterinaria México, 31 (3): 223-230. Vincent se, Herrel A. 2007. Correlatos funcionais e ecológicos de dimorfismos ecologicamente baseados em répteis squamate. Integrative and Comparative Biology, 47 (2): 172-188. Vitt Lj, Zani PA. 1998. O uso de presas entre espécies de lagartos simpátricos na floresta tropical das terras baixas da Nicarágua. Journal of Tropical Ecology, 14 (4): 537-559. Vitt Lj, Avila T,Zani PA, Espósito C. 2002. Life in shade: the ecology of Anolis trachyderma (Squamata: Polychrotidae) in Amazonian Ecuador and Brazil, with comparisons to ecologically similar anoles., Copeia, 2002 (2): 275-286. Vitt Lj, Avila T, Zani PA, Sartorius S, Esposito C. 2003b. Life above ground: Ecology of Anolis fuscoauratus in The Amazon rain forest, and comparisons with its nearest relatives. Canadian Journal of Zoology, 81 (1): 142-156. Zaar JH. 1990. Análise Bioestatística. 4th ed. Upper Saddle River, Nueva Jersey: Prentice-Hall Press. P. 663.