no final da geração de química, cálculo de estados de oxidação dos metais diferentes, deve ser bastante familiar. Eis o que vais fazer. Tome um composto típico – \(Fecl_ 3\), por exemplo. Trata cada ligação entre o metal e um átomo diferente como se fosse uma ligação iónica. Isso significa que os elementos mais eletronegativos (como o cloro, digamos, ou oxigênio) carregam cargas negativas, e o elemento menos eletronegativo (como o metal) carrega a carga positiva.,
se o composto é neutro, a soma dos estados de oxidação também tem que ser neutra. (Se o composto tem uma carga, você ajusta os estados de oxidação em conformidade para que a sua soma seja igual à carga).

Agora, aqui está um exercício divertido. Tente aplicar as mesmas regras ao carbono. Vai parecer um pouco estranho. Por quê? Como existem duas diferenças chave:
- Em Primeiro Lugar, O carbono é muitas vezes mais eletronegativo (2.5) do que alguns dos átomos a que está ligado (tais como H, 2.2)., Então, o que faz neste caso?em segundo lugar, ao contrário das ligações metal-metal, as ligações carbono-carbono são onipresentes. Então, como lida com eles?duas respostas.
- numa ligação C-H, A H é tratada como se tivesse um estado de oxidação de +1. Isto significa que cada ligação C-H irá diminuir o estado de oxidação do carbono em 1.
- quaisquer duas ligações entre o mesmo átomo não afetam o estado de oxidação (lembre-se que o estado de oxidação de Cl em Cl-Cl (e o de H em H-H) é zero. Então um carbono ligado a 4 carbonos tem um estado de oxidação de zero.,assim, ao contrário dos metais, que estão quase sempre em um estado de oxidação positiva, o estado de oxidação do carbono pode variar amplamente, de -4 (em CH4) a +4 (como em CO2). Aqui estão alguns exemplos.
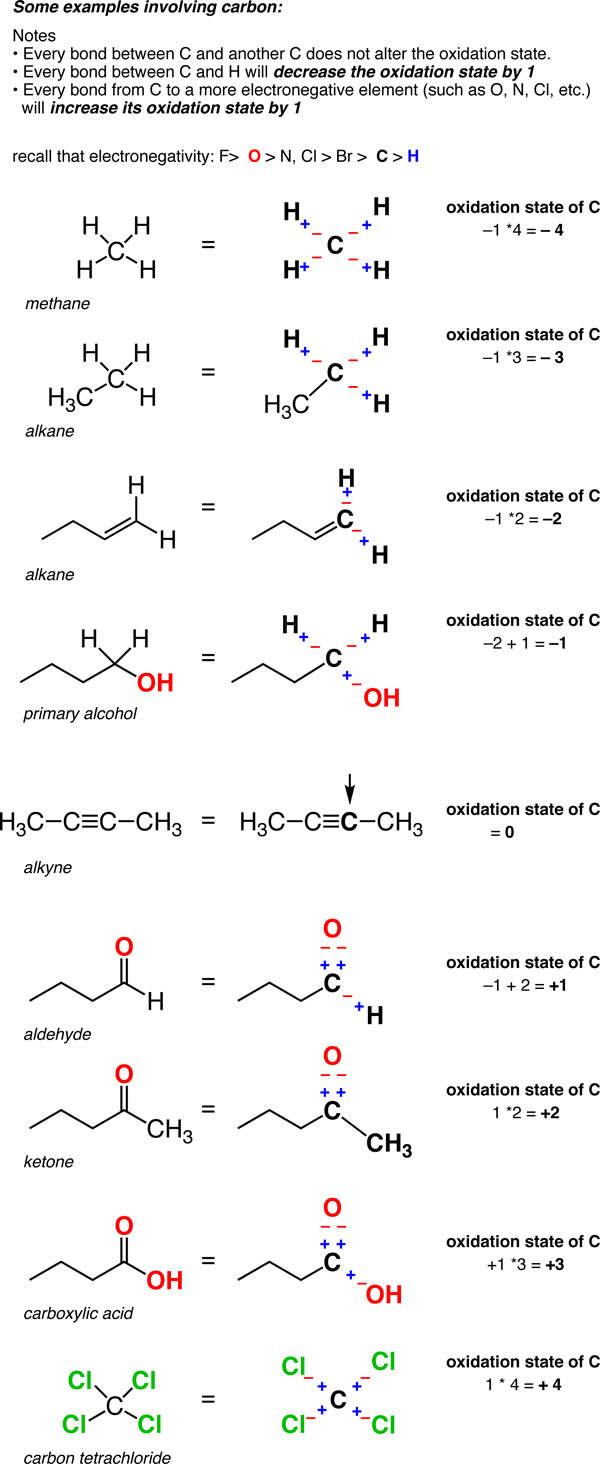
(não se esqueça de que isso é chamado de um “formalismo” por uma razão. A carga sobre o carbono não é realmente +4 ou -4. Mas o formalismo do Estado de oxidação nos ajuda a manter o controle de onde os elétrons estão indo, o que virá a ser útil muito em breve).,
Com uma compreensão de como calcular estados de oxidação de carbono, estamos prontos para o próximo passo: entender as mudanças no estado de oxidação em carbono, através de reações conhecidas como oxidations (onde o estado de oxidação é maior), e as reduções (onde o estado de oxidação é reduzida). Mais sobre isso da próxima vez.