dissulfureto de Carbono Química,Propriedades,Usos, Produção
Usa
Fabricação de rayon de fibras de viscose e celofane filme; solvente de lipídeos, de enxofre, de borracha, fósforo, óleos, resinas e ceras; inseticida. dissulfureto de carbono (bissulfureto de carbono; CS2; CASRN 75-15-0), em sua forma pura, é um líquido incolor que se evapora prontamente à temperatura ambiente, com um odor aromático doce semelhante ao do clorofórmio., Na sua forma impura comercial e reagente, no entanto, dissulfeto de carbono é um líquido amarelado com um odor Incrustante. Ele pode ser detectado por odor a cerca de 1 ppm, mas o senso de cheiro fatiga rapidamente e, portanto, o odor não serve como uma boa propriedade de aviso. Tem uma pressão de vapor de 297 mmHg e solubilidade em água, em peso, de 0,3% a 20 °C (68 °F). Uma vez que o dissulfeto de carbono está no ar, ele vai se decompor em substâncias mais simples dentro de poucos dias após a libertação (OEHHA, 2001).,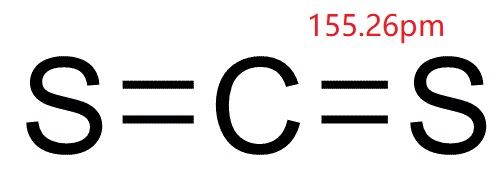
propriedades físicas
líquido límpido, incolor a amarelo pálido; odor etéreo quando puro. As notas técnicas têm um cheiro forte, Sujo, podre e rabanete. Leonardos et al. (1969) reported an odor threshold in air of 210 ppbv. o dissulfureto de carbono é utilizado na fabricação de rayon de celulose regenerada, celofane, desinfectantes do solo e tubos de vaca eletrônica. Outras utilizações importantes são a produção de tetracloreto de carbono, xantatos,tiocianatos, Adesivos de contraplacado e adesivos de borracha., É também utilizado como solvente e eluente de asan para orgânicos adsorvido na análise do ar de charcoalin. o dissulfeto de carbono é usado como matéria-prima na produção de coisas como rayon, celofane, Semicondutores e tetracloreto de carbono, e para fazer alguns pesticidas. É usado como solvente industrial e químico intermediário para dissolver a borracha para produzir pneus (ATSDR, 1996), bem como em fumigação de grãos, pesquisa química analítica, desengorduramento, limpeza a seco e extração de óleo (Finkel et al., 1983)., Fontes naturais de dissulfeto de carbono incluem o oceano aberto, áreas costeiras de alta atividade biológica, redução microbiana de sulfatos no solo, pântanos e algumas plantas superiores onde a fonte de dissulfeto de carbono é as raízes das árvores (Carroll, 1985; Khalil e Rasmussen, 1984).anteriormente, dissulfeto de carbono era usado como um pesticida, onde era tipicamente misturado com tetracloreto de carbono em uma mistura 20/80, respectivamente. Esta mistura foi usada para exterminar insetos e roedores de caixas inteiras de trigo, milho, centeio e outros grãos (Peters et al., 1988)., Os fumigadores de grãos podem ser extremamente intoxicados e podem ser cronicamente expostos ao dissulfureto de carbono. Portanto, no final da década de 1980, todos os pesticidas contendo dissulfeto de carbono como um ingrediente ativo foram cancelados pela Agência de proteção ambiental dos Estados Unidos (EPA dos EUA) (EPA dos EUA, 1999).
utiliza
no fabrico de rayon, tetracloreto de carbono, xantogenatos, desinfectantes do solo, tubos de vácuo electrónicos. Solvente para fósforo, enxofre, selénio, bromo, iodo, gorduras, resinas, borrachas.,
preparação
dissulfeto de carbono é fabricado por aquecimento de vapor de enxofre com carvão, e vapores de condensação do composto formado. Em alternativa, pode ser obtido por aquecimento de enxofre com gás natural ou fracções petrolíferas. Em vez de enxofre, H2S pode ser usado. A reacção ocorre a temperaturas muito elevadas. O produto obtido nestas reacções pode conter impurezas de enxofre. O dissulfureto de carbono é purificado por destilação., o dissulfureto de carbono puro é um líquido incolor com um odor agradável semelhante ao do clorofórmio, enquanto o dissulfureto de carbono impuro é um líquido amarelado com um odor desagradável, como o de rabanetes em decomposição. A exposição ao dissulfureto de carbono ocorre nos locais de trabalho industriais. As indústrias associadas às instalações de gaseificação do carvão libertam mais dissulfureto de carbono, sulfureto de carbonilo e sulfureto de hidrogénio. O dissulfureto de carbono é utilizado em grandes quantidades como produto químico industrial para a produção de fibras de raiom viscose., De facto, a principal fonte de poluição ambiental, tanto no interior como no exterior, pelo dissulfureto de carbono é causada pelas emissões libertadas para o ar pelas instalações de viscose.
ar& reacções à água
altamente inflamáveis. Insolúvel em água. o dissulfureto de carbono tem uma temperatura de autoignição extremamente baixa (125°C). Pode inflamar ou até explodir quando aquecido. O vapor ou líquido tem sido conhecido por inflamar em contato com tubos de vapor, particularmente se enferrujado . Perigo de explosão quando exposto a chamas, calor, faíscas ou atrito., As misturas com tetraóxido de lítio, sódio, potássio ou dinitrogénio podem detonar quando chocadas. Reacção potencialmente explosiva com óxido de azoto, cloro, ácido permanganico(agentes oxidantes fortes). O Vapor incendeia-se em contacto com pó de alumínio ou flúor. Reage violentamente com azidas, etilamina etilenodiamina, etileno imina. Emite fumos altamente tóxicos de óxidos de enxofre quando aquecidos para decomposição . Amida de sódio forma gás H2S tóxico e inflamável com CS2. (714)
perigo
um veneno. Tóxico por absorção cutânea. Os riscos de incêndio e de explosão podem ser inflamados por fricção., Limites de explosividade no AR1-50%. Carcinógeno questionável. Disfunção periférica do sistema ner-vous. perigo para a saúde embora o dissulfureto de carbono apresente baixa toxicidade na maioria dos animais experimentais, a sua toxicidade é relativamente maior nos seres humanos. A via principal de exposição é a inalação de cápsulas. Pode também entrar no corpo através da absorção da pele. O efeito tóxico de uma única exposição é a narcose. A exposição repetida provoca cefaleias, tonturas, fadiga, nervosismo, insónia, psicose, irritação,tremores, perda de apetite, indigestão e perturbações gástricas., Os sintomas acima podem manifestar-se em seres humanos após alguns meses de exposição diária de 4 horas a 150 ppm. Uma concentração inferior a 30 ppm não produz efeitos tóxicos invisíveis. Um exposureto de 15 minutos de 5000 ppm de dissulfeto de carbono no ar pode acontecer aos seres humanos. A ingestão de 5-10 mL de theliquid pode ser fatal. O valor oral DL50 inrats situa-se na gama de 3000 mg/kg.Chapman et al. (1991) reported finger tremor in humans similar to idiopathic Parkinson disformis resulting from chronic exposureto carbon dissulfide-based pesticides., Efeitos similares do dissulfiram do pesticida foram anteriormente atribuídos ao seu metabolito CS2 (Rainey Jr. 1977). Sills et al. (2005) realizaram estudos de neurotoxicidade por inalação do CS2 sobre os organismos-alvo do sistema nervoso central e sobre as porções distais dos axões mielinogrados do sistema nervoso periférico em ratos F344. Os autores observaram que a CS2 produzia protecções intra e intermolecularesin inter – linking in vivo. Tais ligações covalentcross nas proteínas neurofilamentares antes do início das lesões contribuíram para a tumefacção axonal neu-rofilamentosa.Chou et al., (2005) investigaram a toxicidade cutânea induzida pela CS2 em ratinhos e as alterações na permeabilidade epidérmica que conduziram a alterações fisiológicas e patológicas desde a exposição topical até à CS2. Os autores postularam duas vias mecanicistas para explicar as alterações epidérmicas induzidas pela CS2, envolvendo depleção lipídica intercelular e outras com lesões queratinocitárias.
perigo de Incêndio
temperatura de ignição perigosamente baixa: 212F. os vapores podem ser inflamados por contato com a lâmpada de luz comum, quando aquecidos para decomposição, o dissulfureto de carbono emite fumos altamente tóxicos de óxidos de enxofre., Quando aquecido para decomposição, emite fumos altamente tóxicos de óxidos de enxofre e pode reagir vigorosamente com materiais oxidantes. Evitar o ar, oxida-se, halogênios, azidas metálicas, metais, oxidantes; quando exposto ao calor ou a chamas reage violentamente com alumínio, cloro, azidas, hipoclorito de etilamina diamina, etileno imine, flúor, azidas metálicas de lítio, potássio, césio, rubídio e sódio, óxidos de nitrogênio, potássio, zinco e (ácido sulfúrico, além de permanganato). Decompõe-se durante muito tempo.,
inflamabilidade e Explosibilidade
dissulfureto de carbono é extremamente inflamável e é um perigo de incêndio perigoso (NFPArating = 3). É tem uma alta pressão de vapor e extremamente baixa autoignitiontemperatura. Seu vapor é mais pesado do que o ar e pode viajar uma distância considerável para asource de ignição e flash para trás. O vapor forma misturas explosivas no ar em concentrações de 1,3 a 50%. Dissulfeto de carbono pode ser inflamado por superfícies quentes, tais como banhos de costura que normalmente não constituem uma fonte de ignição para outros vapores inflamáveis., A ferrugem (óxido de ferro) pode aumentar a probabilidade de ignição por ondas quentes. Os incêndios com dissulfureto de carbono devem ser extintos com CO2 ou extintores químicos secos. perfil de segurança um veneno humano por via não especificada. Ligeiramente tóxico para os humanos por inalação. Um veneno experimental por via intraperitoneal. Efeitos reprodutivos humanos na espermatogénese por inalação. Efeitos teratogénicos e reprodutivos experimentais. Dados de mutação humana relatados., O principal efeito tóxico é sobre o sistema nervoso central, agindo como narcótico e anestésico em envenenamento agudo com morte devido a insuficiência respiratória. Em envenenamento crônico, o efeito no sistema nervoso é um dos danos centrais e periféricos, que pode ser permanente se os danos foram graves. Líquido inflamável. Perigo de incêndio perigoso quando exposto a calor, chama, faíscas, fricção ou materiais oxidantes. Perigo de explosão grave quando exposto ao calor ou à chama. Ignição e reacção potencialmente explosiva quando aquecida em contacto com ferrugem ou ferro., Mixtures with sodium or potassiumsodum alloys are powerful, shock-sensitive explosives. Explodes on contact with permanganic acid. Potentially explosive reaction with nitrogen oxide, chlorine (catalyzed by iron). Mixtures with dinitrogen tetraoxide are heat-, spark-, and shocksensitive explosives. Reacts with metal azides to produce shockand heat-sensitive, explosive metal azidodtthioformates. Aluminum powder ignites in CS2 vapor. The vapor ignites on contact with fluorine., Reage violentamente com azidas, CsN3, Cl0, etilamina diamina, etileno imine, Pb(N3)2, LiN3, (H2so4 + permanganatos), KN3, RbN3, NaN3, phenylcoppertriphenylphosphine complexos. Incompatível com o ar, os metais e os oxidantes. Para combater o fogo, usar água, CO2, produto químico seco, nevoeiro, névoa. Quando aquecido para decompor emite fumos altamente tóxicos de SO,.,
Potencial de Exposição
dissulfureto de Carbono é usado na fabricação de viscose; sais de amónio; tetracloreto de carbono; carbanilide, xantho genates; agentes de flotação; soildisinfectants; corantes; eletrônicos de tubos de vácuo; vidro óptico;tintas, vernizes, removedores de tintas; vernizes; vernizes; sebo, têxteis, explosivos; combustível de foguete; vidraceiro; conservantes, borracha, cimento; como um solvente para o fósforo,o enxofre, o selênio, o bromo, o iodo; alcalóide celulose; gorduras,ceras, vernizes, cânfora, resinas e frio de borracha vulcanizada., É também utilizado no desengorduramento; análise química; galvanoplastia; fumigação de grãos; extração de óleo e desmame. É amplamente utilizado como um pesticida intermediário.
fonte
identificado entre 139 compostos voláteis identificados em cantaloupe (Cucumis melo var.reticula cv. Sol Real) using an automatic rapid headspace solid phase microextraction method (Beaulieu and Grimm, 2001). Destino ambiental químico/físico. O dissulfureto de carbono hidrolisa em soluções alcalinas para dioxido de carbono e dissulfureto de hidrogênio (Peyton et al., 1976).,numa solução aquosa alcalina contendo peróxido de idrogénio, ditiopercarbonato, sulfureto, enxofre elementar e polissulfuretos podem ser expostos à forma (Elliott, 1990). Numa solução aquosa alcalina (pH ≥8), dissulfidereactou-se carbono com peróxido de hidrogénio formando sulfato e iões carbonato. No entanto, quando o ph é baixado para 7-7. 4, o enxofre coloidal é formado (Adewuyi e Carmichael, 1987).solução Anaqueosa contendo dissulfeto de carbono reage com dióxido de hipoclorito de sódio formando dióxido de carbono, ácido sulfúrico e cloreto de sódio (Patnaik, 1992)., Forma um hemi-hidrato que se decompõe a -3 ° C (Keith and Walters, 1992).FumigantBurns agrícolas com uma chama azul libertando dióxido de carbono e dióxido de enxofre (Windholz et al.,1983). Emite óxidos de enxofre muito tóxicos quando aquecidos à decomposição (Lewis, 1990).Dissulfeto de carbono oxida na troposfera produzindo sulfeto de carbonilo. As semi-vidas atmosféricas para dissulfeto de carbono e sulfeto de carbonilo foram estimadas em aproximadamente 2 anos e 13 dias, respectivamente (Khalil e Rasmussen, 1984)., o carbondissulfureto só deve ser utilizado em zonas livres de fontes de ignição (incluindo placas quentes,lâmpadas incandescentes e banhos de vapor) e esta substância deve ser armazenada em recipientes metálicos bem selados em zonas separadas dos oxidantes. dissulfureto de carbono do n. o ONU 1131, Classe de perigo: 3; Etiquetas: 3-Líquido inflamável, 6.1-materiais venenosos., Métodos de purificação