a teoria quântica nos diz que tanto a luz quanto a matéria consistem de partículas minúsculas que têm propriedades ondulatórias associadas a elas. A luz é composta por partículas chamadas fótons, e a matéria é composta por partículas chamadas elétrons, prótons, nêutrons. É só quando a massa de uma partícula fica pequena o suficiente que as suas propriedades ondulatórias aparecem.
para ajudar a entender tudo isso, vamos olhar como a luz se comporta como uma onda e como uma partícula.,
comportamento de onda da luz
em 1600 Christiaan Huygens, um físico holandês, mostrou que a luz se comporta como uma onda.
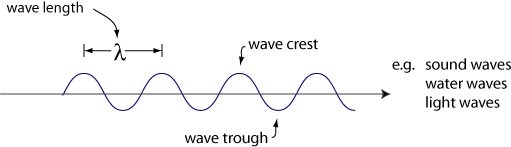
Um comportamento de ondas é de Difração
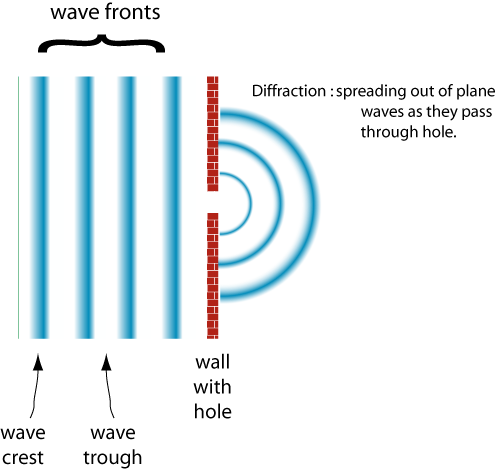
Como a largura da fenda torna-se maior do que o comprimento de onda a onda difratado menos.,
Outro comportamento das ondas de Interferência

foi James Clerk Maxwell, que mostrou, em 1800, que a luz é uma onda eletromagnética que viaja através do espaço à velocidade da luz. A frequência da luz está relacionada com o comprimento de onda de acordo com

vejamos um exemplo de cálculo.
O brilho azul claro emitido pelas lâmpadas de mercury street tem um comprimento de onda de λ = 436nm. Qual é a sua frequência?,

a unidade s-1 é tão comum quando se fala de ondas que lhe foi dado o Nome Hertz. Isto é, 1 s-1 = 1 Hz. Assim, diríamos que a luz com um comprimento de onda de 436 nm corresponde a uma frequência de 6,88 × 1014 Hertz.

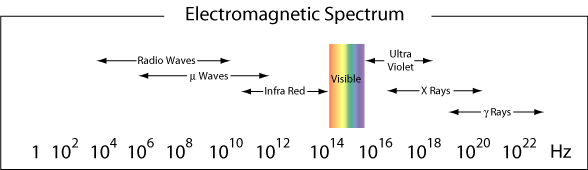
A região de λ ≈ 400-750 nm é visível para o olho humano e, portanto, é chamada a região visível da radiação eletromagnética. Como vimos no exemplo acima, a luz azul está perto do limite de alta frequência de nossos olhos., Luz vermelha, com comprimentos de onda próximos de 750 nm estão no limite de baixa frequência dos nossos olhos. A luz que contém todas as frequências na região visível aparecerá como luz branca.mais geralmente, as diferentes regiões do espectro eletromagnético recebem nomes diferentes. Abaixo estão os nomes dados às diferentes regiões (faixas de frequência) de luz de acordo com a sua gama de frequências.
de Partículas-Como o Comportamento da Luz
neste momento você pode pensar que é bastante óbvio que a luz se comporta como uma onda., Então, como sabemos que a luz é realmente composta de partículas chamadas fótons? O suporte para esta ideia vem de um experimento que é chamado de efeito fotoelétrico.

Uma característica importante deste experimento é que o elétron é emitido do metal com uma energia cinética específica (ou seja, uma velocidade específica).
agora qualquer um que esteja familiarizado com o comportamento das ondas sabe que a energia associada a uma onda está relacionada com a sua amplitude ou intensidade., Por exemplo, no oceano quanto maior a onda, maior a energia associada à onda. Não são as pequenas ondas que te derrubam, são as grandes ondas! Assim, todos os que pensavam que a luz era apenas uma onda estavam realmente confusos quando a intensidade da luz foi aumentada (luz mais brilhante) e a energia cinética do elétron emitido não mudou. O que acontece é que, à medida que você torna a luz mais brilhante, mais elétrons são emitidos, mas todos têm a mesma energia cinética.bem, eles pensaram que a energia cinética do elétron emitido deve depender de algo., Então eles variaram a frequência da luz e isso mudou a energia cinética do elétron emitido.

No entanto, existe uma frequência crítica para cada metal, ν0, abaixo da qual não são emitidos electrões. Isto nos diz que a energia cinética é igual à frequência da luz vezes uma constante (isto é, a inclinação da linha). Essa constante é chamada de Constante de Planck e é dado o símbolo h.
h = 6.63 × 10-34 J · s ← a Constante de Planck
Agora podemos escrever uma equação para a energia cinética do elétron emitido.,
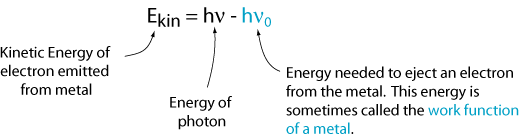
Este resultado não é consistente com a imagem da luz como uma onda. Uma explicação que é consistente com esta imagem é que a luz vem em pacotes discretos, chamados fótons, e cada fóton deve ter energia suficiente para ejetar um único elétron. Caso contrário, nada acontece. Assim, a energia de um único fóton é:
Ephoton = h ν
quando isto foi entendido pela primeira vez, foi um resultado muito surpreendente. Foi Albert Einstein que explicou pela primeira vez o efeito fotoelétrico e recebeu o Prêmio Nobel de Física por este trabalho.,
assim, em resumo-luz é uma partícula com comportamento de onda.
Homework from Chemisty, the Central Science, 10th Ed.
6.5, 6.8, 6.9, 6.11, 6.13, 6.15, 6.17, 6.19, 6.21, 6.23, 6.25, 6.27, 6.29