Nel 1911 erano stati scoperti i componenti dell’atomo. L’atomo consisteva di particelle subatomiche chiamate protoni ed elettroni. Tuttavia, non era chiaro come questi protoni ed elettroni fossero disposti all’interno dell’atomo. J. J. Thomson ha suggerito il modello “plum pudding”. In questo modello gli elettroni e i protoni sono mescolati uniformemente in tutto l’atomo:

Rutherford testò l’ipotesi di Thomson elaborando il suo esperimento “lamina d’oro”., Rutherford ragionò che se il modello di Thomson era corretto, allora la massa dell’atomo era sparsa in tutto l’atomo. Quindi, se sparasse particelle alfa ad alta velocità (nuclei di elio) su un atomo, allora ci sarebbe ben poco da deviare le particelle alfa. Ha deciso di testare questo con un sottile film di atomi d’oro. Come previsto, la maggior parte delle particelle alfa è passata attraverso la lamina d’oro, ma con suo stupore alcune particelle alfa sono rimbalzate quasi direttamente all’indietro.
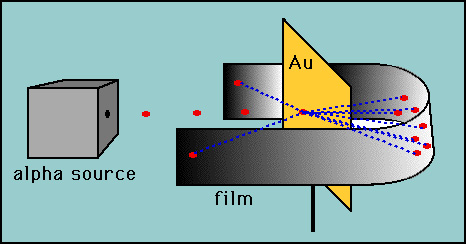
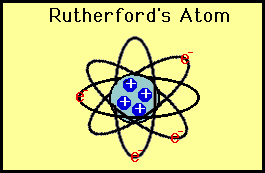
Queste deviazioni non erano coerenti con il modello di Thomson., Rutherford fu costretto a scartare il modello Plum Pudding e ragionò che l’unico modo in cui le particelle alfa potevano essere deviate all’indietro era se la maggior parte della massa di un atomo fosse concentrata in un nucleo. Sviluppò così il modello planetario dell’atomo che metteva tutti i protoni nel nucleo e gli elettroni orbitavano attorno al nucleo come pianeti attorno al sole.