Il ciclo mestruale è una progressione ordinata di eventi ormonali coordinati nel corpo femminile che stimola la crescita di un follicolo a rilasciare un uovo e preparare un sito per l’impianto se si verifica la fecondazione. Le mestruazioni si verificano quando un uovo rilasciato dall’ovaio rimane non fecondato; successivamente, la decidua molliccia dell’endometrio (che è stata innescata per ricevere un uovo fecondato) viene sloughed in un flusso di mestruazioni in preparazione per un altro ciclo.,
Il ciclo mestruale può essere suddiviso in 3 fasi fisiologiche: follicolare, ovulatoria e luteale. Ogni fase ha un ambiente secretorio ormonale distinto. La considerazione degli organi bersaglio di questi ormoni riproduttivi (ipotalamo, ipofisi, ovaio, utero) è utile per identificare il processo patologico responsabile dell’amenorrea di un paziente.
Fase follicolare
In termini fisiologici, il primo giorno delle mestruazioni è considerato il primo giorno del ciclo mestruale. I seguenti 13 giorni del ciclo sono designati come fase follicolare., Poiché i livelli di progesterone, estradiolo e inibina diminuiscono 2-3 giorni prima delle mestruazioni, l’ipofisi inizia a rilasciare livelli più elevati di ormone follicolo-stimolante (FSH), che recluta gli ovociti per il prossimo ciclo mestruale. L’ipotalamo è l’iniziatore della fase follicolare attraverso l’ormone di rilascio delle gonadotropine (GnRH).
La pompa GnRH nell’ipotalamo rilascia GnRH in modo pulsatile nel sistema vascolare portale che circonda la ghiandola pituitaria anteriore. GnRH interagisce con la ghiandola pituitaria anteriore per stimolare il rilascio di FSH nella fase follicolare., L’FSH viene secreto nella circolazione e comunica con le cellule della granulosa che circondano gli ovociti in via di sviluppo.
Quando l’FSH aumenta durante la prima porzione della fase follicolare, si unisce alle cellule della granulosa per stimolare l’aromatizzazione degli androgeni in estradiolo. L’aumento dell’estradiolo e dell’FSH porta ad un aumento del contenuto del recettore FSH nei molti follicoli in via di sviluppo.
Nei prossimi giorni, il costante aumento dei livelli di estradiolo (E2) esercita un’influenza soppressiva progressivamente maggiore sul rilascio di FSH ipofisario., Solo un follicolo di piombo selezionato, con il più grande serbatoio di estrogeni, può sopportare il declino dell’ambiente FSH. Gli ovociti rimanenti che sono stati inizialmente reclutati con il follicolo di piombo subiscono atresia.
Immediatamente prima dell’ovulazione, la combinazione di E2 e FSH porta alla produzione di recettori dell’ormone luteinizzante (LH) sulle cellule della granulosa che circondano il follicolo di piombo.
Durante la fase follicolare tardiva, l’estrogeno ha un’influenza positiva sulla secrezione di LH, invece di sopprimere la secrezione di LH ipofisario come fa all’inizio della fase follicolare., Per avere questo effetto positivo, il livello E2 deve raggiungere un’elevazione sostenuta per diversi giorni. L’impulso di LH promuove la maturazione dell’ovocita dominante, il rilascio dell’ovocita e quindi la luteinizzazione delle cellule della granulosa e delle cellule della teca circostanti del follicolo dominante con conseguente produzione di progesterone.
Il livello appropriato di progesterone derivante dal follicolo dominante in maturazione contribuisce alla tempistica precisa dell’ondata di LH a metà ciclo. E2 promuove la crescita della ghiandola endometriale uterina, che consente l’impianto futuro.,
Fase ovulatoria
L’ovulazione si verifica circa 34-36 ore dopo l’inizio del picco di LH o 10-12 ore dopo il picco di LH e 24-36 ore dopo i livelli di picco di E2. L’aumento del progesterone aumenta la distensibilità della parete follicolare e migliora l’attività enzimatica proteolitica, che alla fine rompe la parete follicolare collagena.
Dopo che l’ovulo viene rilasciato, le cellule della granulosa aumentano di dimensioni e assumono una pigmentazione giallastra caratteristica della luteina., Il corpo luteo produce quindi estrogeni, progesterone e androgeni e diventa sempre più vascolarizzato.
Fase luteale
La durata della vita e la capacità steroidogenica del corpo luteo dipendono dalla continua secrezione di LH dalla ghiandola pituitaria. Il corpo luteo secerne progesterone che interagisce con l’endometrio dell’utero per prepararlo per l’impianto. Questo processo è definito decidualizzazione endometriale.
Nel normale ciclo mestruale ovulatorio, il corpo luteo diminuisce di funzione 9-11 giorni dopo l’ovulazione., Se il corpo luteo non viene salvato dall’ormone della gonadotropina corionica umana (hCG) dalla placenta in via di sviluppo, le mestruazioni si verificano in modo affidabile 14 giorni dopo l’ovulazione. Se il concepimento si verifica, HCG placentare interagisce con il recettore LH per mantenere la funzione luteale fino a quando la produzione placentare di progesterone è ben stabilita.
Pubertà
La progressione ordinata della pubertà inizia con il germogliamento del seno (thelarche), la crescita accelerata e le mestruazioni (menarche)., Adrenarche, la crescita sessuale dei capelli, è indipendente dalla funzione GnRH e si verifica in genere tra il germogliamento del seno e la crescita accelerata, ma può verificarsi ovunque lungo la timeline della pubertà. La secrezione di deidroepiandrostenedione (DHEA) avvia adrenarche. Negli Stati Uniti, l’età media delle ragazze al menarca è di 12,6 anni, con una gamma di 9-15 anni. (L’età 15 anni è 2 deviazioni standard sopra la media, mentre l’età 16 anni è 3 deviazioni standard sopra.) La progressione della pubertà richiede l’esposizione agli estrogeni.,
Le mestruazioni che si verificano su un pattern ciclico prevedibile sono associate allo sviluppo del follicolo e all’ovulazione. Alla nascita, i neonati di sesso femminile hanno un numero predeterminato di follicoli primordiali. Durante il primo trimestre di gravidanza, l’oogonia fetale aumenta di numero per mitosi rapida. Dalla 16 alla 20a settimana di gravidanza, sono presenti fino a 6 milioni di oogonia e la mitosi si ferma. Dopo aver raggiunto un numero massimo di cellule di oogonia a 20 settimane, le cellule di supporto avvolgono l’ovocita formando il follicolo primordiale., L’ovocita all’interno del follicolo primordiale entrerà nella meiosi I, arrestandosi allo stadio diplotene della profase. Nelle restanti 20 settimane di gravidanza, oltre 4 milioni di ovociti subiranno atresia spontanea con conseguente 2 milioni di ovociti disponibili alla nascita. L’atresia continua in modo tale che solo 300.000 ovociti rimangono al momento della pubertà. Fino a 500 ovociti ovuleranno durante la vita riproduttiva di una donna con il resto sottoposto ad apoptosi., Gli ovociti rimarranno arrestati alla Meiosi I a meno che l’ovocita non sia scelto per progredire verso un follicolo primario ed eventualmente il follicolo dominante scelto per l’ovulazione. Dopo l’aumento di LH associato all’ovulazione, l’ovocita viene stimolato a completare la meiosi 1 con successivo arresto alla metafase della meiosi 2. Il completamento della meiosi 2 si verifica dopo la fecondazione di un singolo sperma. Alla nascita, i neonati di sesso femminile hanno un numero predeterminato di follicoli primordiali che vengono arrestati durante la meiosi 1 allo stadio diplotene della profase fino alla stimolazione alla pubertà., Fino alla pubertà, l’ipotalamo è in uno stato di riposo. A circa 8 anni di età, la pompa GnRH viene riattivata sotto il controllo primario di Kisspeptin.
Menarca e cicli mestruali sostenuti richiede la normale funzione dell’asse endocrino comprendente l’ipotalamo, l’ipofisi e le ovaie (vedere l’immagine sotto). Qualsiasi interruzione in questo asse può causare amenorrea. Definire il livello di disfunzione primaria è fondamentale nel determinare la fisiopatologia dell’amenorrea.,
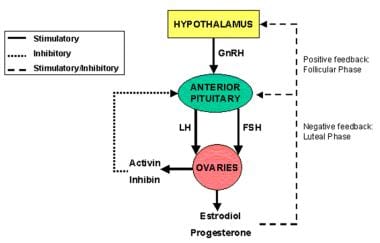 L’ipotalamo, l’ipofisi e le ovaie formano un asse endocrino funzionale, noto come asse HPO con regolamenti ormonali e cicli di feedback.
L’ipotalamo, l’ipofisi e le ovaie formano un asse endocrino funzionale, noto come asse HPO con regolamenti ormonali e cicli di feedback. Tipi di amenorrea basati sull’eziologia dell’asse HPO
Amenorrea ipotalamica
La disfunzione ipotalamica provoca una diminuzione o inibizione della secrezione di GnRH, che influenza il rilascio pulsatile di gonadotropine ipofisarie, LH e FSH, causando anovulazione. Una causa comune di amenorrea è l’amenorrea ipotalamica funzionale., È caratterizzato dalla secrezione ipotalamica anormale di GnRH, dalle pulsazioni diminuite della gonadotropina, dalle concentrazioni basse o normali di LH, dai picchi assenti di LH, dallo sviluppo follicolare anormale e dall’estradiolo basso del siero. Le concentrazioni sieriche di FSH sono generalmente nell’intervallo normale, con un elevato rapporto FSH-LH.
L’amenorrea ipotalamica funzionale può essere causata da disturbi alimentari, esercizio fisico o alti livelli di stress fisico o mentale prolungato. Questo può anche includere importanti disturbi psichiatrici come la depressione., Ipotiroidismo, ipertiroidismo, sarcoidosi, galattosemia o qualsiasi grave condizione medica cronica può causare amenorrea.
L’ipogonadismo ipogonadotropico idiopatico porta a bassi livelli di gonadotropina (FSH / LH). Quando ciò si verifica con l’anosmia, viene diagnosticata come sindrome di Kallmann, i cui segni includono difetti facciali della linea mediana, agenesia renale e carenze neurologiche. La sindrome di Kallmann deriva da un fallimento delle cellule GnRH di migrare verso il proencefalo, un fenomeno associato a mutazioni nei geni KAL1, FGFR1, FGF8, PROKR2 e PROK2., La sindrome di Kallmann si presenta più comunemente come un disturbo recessivo legato all’X causato da un difetto KAL1. Le eredità autosomiche dominanti e autosomiche recessive sono meno comuni. Per informazioni dettagliate, vedere Deficit di ormone di rilascio delle gonadotropine negli adulti.
L’evidenza suggerisce una correlazione negativa tra i livelli di grasso corporeo e le anomalie mestruali. Un livello critico di grasso corporeo deve essere presente affinché il sistema riproduttivo funzioni normalmente.,
In alcune atlete, gli effetti sinergici di un eccessivo esercizio fisico e di un’alimentazione disordinata causano una grave soppressione del GnRH, portando a bassi livelli di estradiolo. La triade atletica femminile, come definita dall’American College of Sports Medicine, è caratterizzata da una bassa disponibilità di energia con o senza alimentazione disordinata, amenorrea e osteoporosi. Uno studio del 2009 di DeSouza et al ha scoperto che circa la metà delle donne che esercitano potrebbe essere amenorroica. Amenorrea può essere la presentazione iniziale della triade atleta femminile.,
Le cause funzionali di amenorrea includono gravi malattie croniche, rapida perdita di peso, malnutrizione, depressione o altri disturbi psichiatrici, abuso di droghe ricreative e uso di droghe psicotrope.
Amenorrea ipofisaria
Una carenza di FSH e LH può derivare da mutazioni del gene del recettore del GnRH, sebbene tali mutazioni siano rare. Mutazioni nel gene beta FSH sono stati anche associati con amenorrea; le donne con queste mutazioni hanno bassi livelli di FSH ed estradiolo e alti livelli di LH.,
L’amenorrea primaria causata da iperprolattinemia è una condizione rara caratterizzata dall’insorgenza di thelarche e pubarche in età appropriata ma arresto dello sviluppo puberale prima del menarca. L’iperprolattinemia è associata alla soppressione del GnRH dall’ipotalamo e alla successiva inibizione di LH e FSH, funzione gonadica soppressa e galattorrea. I prolattinomi sono la causa più comune di iperprolattinemia persistente, che rappresenta il 40-50% dei tumori ipofisari. I prolattinomi sono più comunemente noti nell’amenorrea secondaria.,
I tumori ipofisari possono sopprimere la secrezione di gonadotropina, come nella malattia di Cushing o tumori ipotalamici, craniofaringioma o germinoma. Lesioni cerebrali o irradiazione cranica possono anche provocare amenorrea. Altre cause ipofisarie includono la sindrome di sella vuota, infarto ipofisario, emocromatosi e sarcoidosi.
Cause ovariche di amenorrea primaria
La disgenesia gonadica è caratterizzata dalla perdita congenita o dal sottosviluppo delle cellule germinali all’interno della gonade durante l’organogenesi., Le gonadi di solito contengono solo tessuto fibroso e sono chiamate gonadi a strisce. Nelle femmine, la forma più comune di disgenesia gonadica è la sindrome di Turner (45, X), in cui i livelli di gonadotropina, in particolare i livelli di FSH, sono elevati durante la prima infanzia e dopo l’età 9-10 anni.
Ulteriori anomalie associate alla sindrome di Turner includono bassa statura, collo palmato, coartazione dell’aorta (10%), anomalie renali (50%), ipertensione, nevi pigmentati, breve metacarpo e metatarsi, tiroidite di Hashimoto, obesità e osteoporosi., L’esaurimento dei follicoli ovarici causa amenorrea.
L’insufficienza ovarica primaria (POI) spontanea 46,XX (nota anche come insufficienza ovarica prematura e menopausa precoce) colpisce 1 donna su 10.000 per età 20 anni, 1 donna su 1000 per età 30 anni, 1 donna su 250 per età 35 anni e 1 donna su 100 per età 40 anni. POI è ipogonadismo ipergonadotropico, caratterizzato da oligomenorrea / amenorrea, carenza di estrogeni e sintomi associati come vampate di calore, secchezza vaginale, dispareunia e insonnia., Per informazioni più dettagliate, vedere Insufficienza ovarica primaria spontanea e Insufficienza ovarica prematura.
La permutazione X fragile rappresenta circa il 6% dei casi di POI palese. È causato da un aumento del numero di ripetizioni CGG nel gene FMR1 situato sul braccio lungo del cromosoma X. Nella permutazione, il numero di ripetizioni CGG varia da 55 a 200. Circa il 21% dei portatori di permutazione ha POF/POI rispetto all ‘ 1% della popolazione generale. L’ooforite autoimmune si verifica nel 3-4% dei casi di POI.,
L’amenorrea è anche osservata nella disgenesia gonadica pura 46, XX e nella disgenesia gonadica XY 46. Queste donne hanno livelli di FSH significativamente elevati a causa dell’assenza di follicoli ovarici e della riduzione del feedback negativo sull’FSH da estradiolo e inibina A e B.
Le prime fasi della formazione testicolare richiedono l’azione di diversi geni, di cui uno dei primi e più importanti è la regione che determina il sesso del cromosoma Y (SRY)., Nella sindrome di Swyer, una sindrome di regressione testicolare che si verifica molto presto nell’embriogenesi, il feto ha un cariotipo 46, XY ma con mutazioni del gene SRY tali che i testicoli non si formano mai e l’ormone anti-mülleriano non viene prodotto, con conseguente fenotipo femminile.
Questi individui hanno una vagina, utero e tube di Falloppio. Le cellule germinali nelle gonadi vengono perse prima della nascita. Le gonadi della striscia devono essere rimosse chirurgicamente a causa del rischio aumentato di sviluppare il tumore delle cellule germinali., La disgenesi gonadica pura si verifica quando la sindrome colpisce solo le gonadi e non si notano altre caratteristiche dismorfiche.
La sindrome dell’ovaio policistico (PCOS) di solito si presenta come amenorrea secondaria, ma in alcuni casi può presentarsi come amenorrea primaria. Vedere Sindrome dell’ovaio policistico per ulteriori informazioni.
Anomalie congenite e anatomiche
Un utero e un tratto vaginale brevettato sono necessari per il normale flusso mestruale. Le anomalie del tratto riproduttivo femminile rappresentano circa un quinto dei casi primari di amenorrea., Il dolore pelvico ciclico è comune nelle ragazze con disturbi del tratto riproduttivo che coinvolgono l’ostruzione del deflusso. L’imene imperforato provoca un’ostruzione del deflusso. Questi pazienti possono avere sangue nella vagina che si raccoglie e può provocare una massa perirettale. Il setto vaginale trasversale può essere ovunque lungo il tratto tra l’anello imenale e la cervice.
L’agenesia vaginale o disgenesia mülleriana (nota anche come sindrome di Mayer-Rokitansky-Kuster-Hauser) è causata da agenesia o agenesia parziale del sistema dotto mülleriano., È caratterizzato da aplasia congenita dell’utero e dei due terzi superiori della vagina nelle donne che mostrano un normale sviluppo delle caratteristiche sessuali secondarie e un normale cariotipo 46,XX. Il primo segno è l’amenorrea primaria. Colpisce 1 delle 4500 donne. Può essere associato a difetti renali, vertebrali e, in misura minore, uditivi e cardiaci.,
Difetti dei recettori e degli enzimi
Iperplasia surrenalica congenita a causa della carenza di alfa-idrossilasi 17 (CYP17) provoca un eccesso di desossicortisone da produrre e carenza di cortisolo e steroidi sessuali surrenali e gonadici. I pazienti con questo disturbo che soffrono di amenorrea primaria possono essere maschi genotipici (XY) o femmine (XX).
La sindrome da insensibilità agli androgeni completa è causata da un recettore androgeno difettoso., Sebbene i pazienti con questa sindrome abbiano un cariotipo 46, XY e producano testosterone derivato testicolarmente, il testosterone non può attivare la trascrizione cellulare; pertanto, il paziente ha genitali esterni femminili. Nella maggior parte dei casi il disturbo è X-linked. I testicoli, situati internamente e talvolta nelle labbra o nell’area inguinale, producono anche l’ormone inibitore mülleriano, quindi tutte le strutture derivate da müller (cioè le tube di Falloppio, l’utero, il terzo superiore della vagina) sono assenti.,
La resistenza alla gonadotropina è rara, ma le mutazioni inattivanti dei recettori per LH e FSH possono causare amenorrea anovulatoria.
La carenza di aromatasi è anche una malattia rara. Aromatasi catalizza la conversione di androgeni in estrogeni. Quando la sintesi dell’estrogeno non può accadere, livelli aumentati di risultato del testosterone e virilization della femmina accade. Spesso, le ragazze hanno ovaie cistiche e amenorrea risultante.