Le molecole o gli ioni che possono donare o accettare un protone, a seconda delle loro circostanze, sono chiamati specie anfiprotiche. La specie anfiprotica più importante è l’acqua stessa. Quando un acido dona un protone all’acqua, la molecola d’acqua è un accettore di protoni e quindi una base. Al contrario, quando una base reagisce con l’acqua, una molecola d’acqua dona un protone, e quindi agisce come un acido.
Un altro importante gruppo di specie anfiprotiche sono gli amminoacidi., Ogni molecola di amminoacido contiene un gruppo carbossilico acido e un gruppo amminico di base. Infatti gli amminoacidi di solito esistono in forma zwitterion (tedesco per “doppio ion”), dove il protone si è trasferito dal carbossile al gruppo amminico. Nel caso della glicina, ad esempio, lo zwitterione è
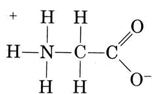
Lo zwitterione può donare uno dei protoni dall’N, proprio come uno ion NH4+ può donare un protone. D’altra parte, il suo COO– end può accettare un protone, proprio come un CH3COO– ion può., Other common amphiprotic species are HCO3–, H2PO4–, HPO42–, and other anions derived from diprotic or triprotic acids.