La théorie quantique nous dit que la lumière et la matière sont constituées de minuscules particules qui ont des propriétés ondulatoires qui leur sont associées. La lumière est composée de particules appelées photons et la matière est composée de particules appelées électrons, protons, de neutrons. Ce n’est que lorsque la masse d’une particule devient suffisamment petite que ses propriétés ondulées apparaissent.
Pour les aider à comprendre tout cela, regardons comment la lumière se comporte comme une onde et comme une particule.,
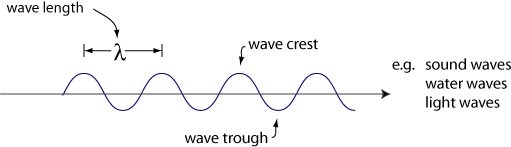
comportement ondulatoire de la lumière
dans les années 1600, Christiaan Huygens, un physicien néerlandais, a montré que la lumière se comporte comme une onde.
Un comportement de vagues, c’est la Diffraction
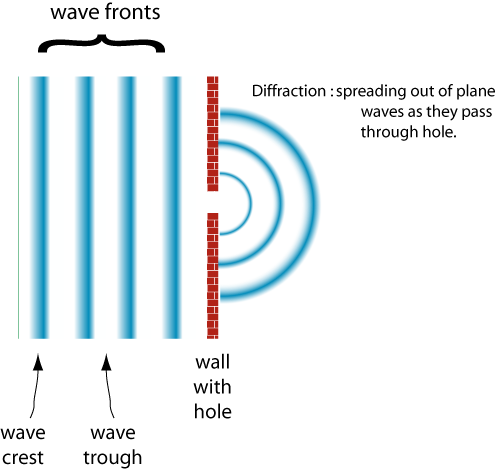
Comme la largeur de la fente devient plus grande que la longueur d’onde de l’onde est diffractée moins.,
un autre comportement des ondes est L’interférence

C’est James Clerk Maxwell qui a montré dans les années 1800 que la lumière est une onde électromagnétique qui traverse l’espace à la vitesse de la lumière. La fréquence de la lumière est liée à sa longueur d’onde selon l’

prenons un exemple de calcul.
la lueur bleu clair émise par les lampadaires à mercure a une longueur d’onde de λ = 436 Nm. Quelle est sa fréquence?,

l’unité s-1 est si courante lorsqu’on parle d’ondes qu’on lui a donné le nom Hertz. Autrement dit, 1 s-1 = 1 Hz. Donc, nous dirions que la lumière avec une longueur d’onde de 436 nm correspond à une fréquence de 6,88 × 1014 Hz.

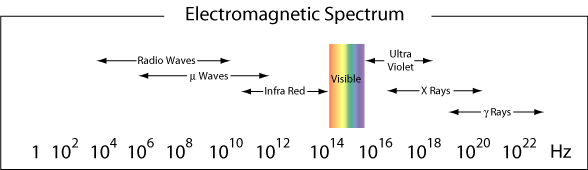
La région de λ ≈ 400-750 nm est visible pour l’œil humain et est donc appelé la région visible du rayonnement électromagnétique. Comme nous l’avons vu dans l’exemple ci-dessus, la lumière bleue est proche de la limite haute fréquence de nos yeux., La lumière rouge, avec des longueurs d’onde proches de 750 nm, est à la limite des basses fréquences de nos yeux. La lumière qui contient toutes les fréquences dans la région visible apparaîtra sous forme de lumière blanche.
plus généralement, les différentes régions du spectre électromagnétique reçoivent des noms différents. Voici les noms donnés aux différentes régions (gammes de fréquences) de la lumière en fonction de leur gamme de fréquences.
des Particules Comme le Comportement de la Lumière
À ce stade, vous pourriez penser qu’il est assez évident que la lumière se comporte comme une onde., Alors, pourquoi, comment savons-nous que la lumière est vraiment composé de particules appelées photons? Le soutien à cette idée provient d’une expérience appelée l’effet photoélectrique.

Une caractéristique importante de cette expérience est que l’électron est émis à partir du métal avec une énergie cinétique (c’est à dire une vitesse spécifique).
maintenant, quiconque connaît le comportement des ondes sait que l’énergie associée à une onde est liée à son amplitude ou son intensité., Par exemple, à l’océan, plus la vague est grande, plus l’énergie associée à la vague est élevée. Ce ne sont pas les petites vagues qui vous renversent, ce sont les grosses vagues! Ainsi, tous ceux qui pensaient que la lumière n’était qu’une onde étaient vraiment confus lorsque l’intensité de la lumière était augmentée (lumière plus vive) et que l’énergie cinétique de l’électron émis ne changeait pas. Ce qui se passe, c’est que lorsque vous rendez la lumière plus lumineuse, plus d’électrons sont émis, mais tous ont la même énergie cinétique.
Eh bien, ils pensaient que l’énergie cinétique de l’électron émis devait dépendre de quelque chose., Ils ont donc fait varier la fréquence de la lumière et cela a changé l’énergie cinétique de l’électron émis.

cependant, il existe une fréquence critique pour chaque métal, ν0, en dessous de laquelle aucun électron n’est émis. Cela nous dit que l’énergie cinétique est égale à la fréquence de la lumière le temps d’une constante (c’est à dire, la pente de la ligne). Cette constante est appelée constante de Planck et reçoit le symbole h.
h = 6,63 × 10-34 J · s ← constante de Planck
maintenant, nous pouvons écrire une équation pour l’énergie cinétique de l’électron émis.,
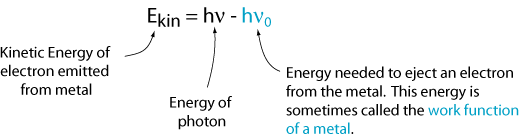
Ce résultat n’est pas cohérent avec l’image de la lumière comme une onde. Une explication qui est cohérente avec cette image est que la lumière vient dans des paquets discrets, appelés photons, et chaque photon doit avoir suffisamment d’énergie pour éjecter un seul électron. Sinon, rien ne se passe. Ainsi, l’énergie d’un photon unique est:
Ephoton = h ν
Quand ce fut d’abord compris, c’était un résultat surprenant. C’est Albert Einstein qui a expliqué le premier effet photoélectrique et il a reçu le prix Nobel de physique pour ce travail.,
donc, en résumé-la lumière est une particule avec un comportement ondulatoire.
devoirs de Chemisty, la science centrale, 10e éd.
6.5, 6.8, 6.9, 6.11, 6.13, 6.15, 6.17, 6.19, 6.21, 6.23, 6.25, 6.27, 6.29