En 1911, les composants de l’atome avait été découvert. L’atome était constitué de particules subatomiques appelées protons et électrons. Cependant, il n’était pas clair comment ces protons et électrons étaient disposés dans l’atome. J. J. Thomson a suggéré le modèle » plum pudding ». Dans ce modèle, les électrons et les protons sont uniformément mélangés dans tout l’atome:

Rutherford a testé L’hypothèse de Thomson en concevant son expérience « feuille d’or »., Rutherford a estimé que si le modèle de Thomson était correct, la masse de l’atome était répartie dans tout l’atome. Ensuite, s’il tirait des particules alpha à haute vitesse (noyaux d’hélium) sur un atome, il y aurait très peu de choses pour dévier les particules alpha. Il a décidé de tester cela avec un mince film d’atomes d’or. Comme prévu, la plupart des particules alpha ont traversé la feuille d’or, mais à son grand étonnement, quelques particules alpha ont rebondi presque directement vers l’arrière.
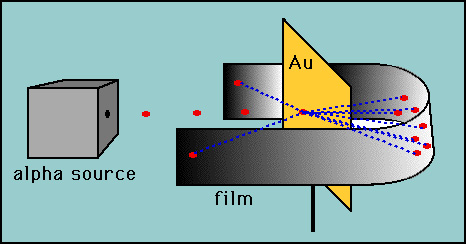
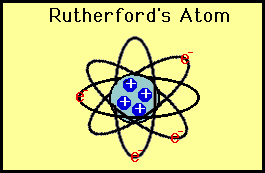
Ces déviations ne sont pas compatibles avec Thomson modèle., Rutherford a été forcé de jeter le modèle de Plum Pudding et a estimé que la seule façon dont les particules alpha pourraient être déviées vers l’arrière était si la majeure partie de la masse dans un atome était concentrée dans un noyau. Il développa ainsi le modèle planétaire de l’atome qui plaçait tous les protons dans le noyau et les électrons orbitaient autour du noyau comme des planètes autour du soleil.