certaines espèces D’Anolis présentent un dimorphisme trophique, qui peut impliquer l’identité de l’élément (Rodríguez 2010), la quantité, La fréquence et le volume des proies (Perry 1996). Dans ces cas, les différences pourraient être liées au dimorphisme de la taille sexuelle (Taille du corps et dimensions de la tête) (Schoener 1968), au comportement de recherche de nourriture (lié aux différences dans les rôles sexuels masculins et féminins) (Butler et Losos 2002, Butler et al., 2007, Perry 1996, Steffen 2009, Vincent et Herrel 2007), variation de l’utilisation de la perche (Perry 1996, Schoener 1967), densité de population (Stamps et al. 1997), ou des différences dans les besoins énergétiques pendant la saison de reproduction (Schoener, 1968; Vitt et Zani, 1998).
Le régime alimentaire des anoles varie d’une espèce à l’autre et au sein de l’espèce, et au moins une partie de cette variation semble liée aux différences dans l’utilisation des ressources structurelles (type et hauteur de perche) et l’accès connexe, ainsi que l’abondance des différentes proies (Fleming et Hooker, 1975, Vitt et Zani, 1998, Vitt et al. 2002, 2003b)., Au sein des espèces, des variations dans l’écologie alimentaire ont été enregistrées chez des anoles amazoniennes comme A. trachyderma (Vitt et al. 2002), A. punctatus et A. transversalis (Vitt et coll. 2003A), et A. fuscoauratus (Vitt et al. 2003b).
la variation géographique de facteurs tels que les interactions compétitives interspécifiques, la disponibilité des proies et l’utilisation des ressources structurelles a été suggérée comme la cause sous-jacente de la variation intraspécifique des habitudes alimentaires chez ces espèces (Fleming et Hooker 1975, Gutiérrez et Rumiz 2002, Régnière 2009, Rodríguez 2010, Schoener 1968) et les lézards en général (Aun et al. 1999).,
Anolis ventrimaculatus Boulenger 1911 est une espèce des Hautes Terres andines répartie dans l’ouest de la Colombie. Cette espèce présente un dimorphisme sexuel de taille et de forme corporelle, qui varie également selon les localités (Calderón-Espinosa et al. 2013). Le dimorphisme de ces caractères suggère des différences dans l’utilisation des ressources entre les sexes et peut-être, au moins une certaine variation entre les populations. Nous avons évalué cette hypothèse en décrivant le régime alimentaire des mâles et des femelles à différentes localités de l’aire de répartition de l’espèce.,
matériaux et méthodes
Nous avons mesuré la longueur d’évent du museau (SVL) de chaque individu avec un étrier numérique à 0,1 mm et enlevé les estomacs et les parties proximales des intestins. Selon Triplehorn et Johnson (2005), les estomacs et le contenu intestinal ont été identifiés selon l’ordre et la famille dans la mesure du possible. Nous avons ensuite estimé le nombre de proies en utilisant des têtes, des ailes, des pattes, des antennes et d’autres parties du corps identifiables. Comme les proies ont été partiellement digérées, nous n’avons pas pu estimer la taille des proies. Par la suite dans cet article, « item » fait référence à l’identité taxonomique (par exemple,, Orthoptera, Coleoptera), alors que « prey » se réfère à des proies individuelles ingérées par les lézards.
l’analyse de Données. Nous avons évalué le dimorphisme alimentaire aux niveaux des espèces et des localités en comparant le nombre et la fréquence des éléments observés (ceux identifiés au niveau de l’ordre) entre les sexes à l’aide de tests du Chi carré. Le nombre de proies a été comparé par des tests t, après avoir évalué toute relation avec la LV du lézard à l’aide de tests de corrélation de Spearman (Zaar, 1990). Nous avons également analysé les pourcentages d’utilisation d’articles qui représentaient > 70% d’ingesta, et utilisé le test t pour les comparer entre les sexes., Proie utilisation a été dérivée à partir du nombre de proies par poste par personne/nombre total de proies ingérées par chaque individu.
nous avons également analysé la variation géographique en utilisant le test ANOVA et a posteriori Tukey pour comparer les régimes alimentaires des femelles et des mâles et le pourcentage d’utilisation d’articles qui représentaient> 70% d’ingesta dans les différentes localités.
la normalité et l’homocédasticité ont été évaluées pour toutes les données et transformées en Log10 pour celles qui ne répondaient pas aux hypothèses. Les analyses de données ont été effectuées dans Statistica ver. 8.0 (Démo).,
largeur des niches trophiques, chevauchement des niches et indices de dominance. Nous avons estimé la largeur des niches trophiques pour les mâles et les femelles en utilisant l’indice de Simpson inverse (1949) comme suit: B = (Σpi2)-1,
où p représente le pourcentage d’utilisation de l’élément I. nous avons également déterminé si les mâles et les femelles utilisaient des ressources alimentaires similaires en estimant le chevauchement des niches comme proposé par Pianka (1973):
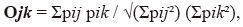
où pij pik représente pourcentage D’utilisation de la ressource I par les femmes (J) et les hommes (K). Ces indices ont été calculés à L’aide du logiciel Ecosim.,
enfin, nous avons estimé l’indice de dominance Lambda (Aun et al. 1999, Montori 1988, 1991, 1992) comme suit:
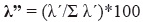
dans cette équation, λ’ = λ/n*100 et λ = Σpi2,
résultats
Tous les 118 individus examinés avaient des ingesta dans l’estomac et les intestins proximaux. Au total, 1021 proies (593 chez les femelles et 428 chez les mâles) ont été classées dans 16 items au niveau ordinal des insectes, des arachnides (Araneae), des myriapodes et des crustacés (des isopodes étaient présents chez une femelle)., Les hyménoptères et les coléoptères, qui présentaient la plus grande diversité taxonomique au niveau familial, ont été classés en 24 familles. Certains individus avaient ingéré du matériel végétal identifié comme Marchantiophyta, hangar et petites pierres. Ceux-ci ont été considérés comme accidentels, car ils n’ont été observés que chez trois individus (tableau 1) et ont vraisemblablement été ingérés par adventice.,
ces lézards se nourrissent principalement de coléoptères, D’hyménoptères (principalement de fourmis) et de larves d’insectes, les coléoptères étant classés comme élément principal, tandis que les hyménoptères et les larves étaient classés comme éléments secondaires et que d’autres étaient considérés comme accidentels (tableau 1). La plupart des estomacs de toutes les localités contenaient des nématodes parasites non identifiés.
dimorphisme sexuel et alimentation. Quatorze éléments ont été observés dans les estomacs de chaque sexe. Les mâles et les femelles s’étaient nourris du même nombre d’items (X2 = 1,37, p > 0,05). Cependant, certains items n’ont été observés que chez les mâles ou les femelles., Les isopodes et les isoptères (petites et surtout terrestres) n’ont été trouvés que chez une et deux femelles, respectivement, alors que les trichoptères et les neuroptères (grandes et surtout arboricoles) n’étaient présents que chez deux mâles de localités différentes. Malgré ces différences, les régimes alimentaires des hommes et des femmes étaient très similaires, comme l’indique le chevauchement très élevé des niches (0,99). Les breadths de Niche étaient de 6,09 pour les mâles et de 6,17 pour les femelles.
Les mâles et les femelles de la localité un ont présenté un pourcentage différent d’utilisation d’orthoptères (t = 3,76, p = 0,002) et d’hyménoptères (t = 2,44, p = 0.,02), et ceux de la localité six ont ingéré différentes quantités d’orthoptères (t = 2,24, p = 0,04). À la localité deux, seules les femelles se nourrissaient d’orthoptères. Les hommes et les femmes dans d’autres localités ne différaient pas significativement dans l’utilisation de ces articles.
la variation Géographique. Seuls les articles qui étaient apparemment exclusifs des hommes ou des femmes, et présents dans de très basses fréquences et de faibles pourcentages d’utilisation présentaient des variations géographiques., On a observé des isopodes seulement à la localité un, des isoptères chez deux femelles à la localité six, des trichoptères à la localité trois, des neuroptériens à la localité deux, des Blattodea aux localités deux et six, des myriapodes aux localités trois et six et des collemboles aux localités trois et quatre (figure 1).
Les mâles ont mangé un nombre similaire de proies à toutes les localités, mais pas les femelles (F60, 5 = 3,56, p = 0,007) avec des différences significatives observées entre les femelles à la localité un et celles des localités trois, quatre et cinq (test de Tukey, p < 0,05).,
DISCUSSION
Anolis ventrimaculatus est un insectivore comme la plupart des autres espèces d’Anolis, y compris A. tolimensis (Ardila-Marín et al. 2008), A. homolechis (Rodríguez 2010), A. cybotes (Fobes et coll. 1992), et A. aeneus (Timbres et coll. 1997). Les coléoptères, les hyménoptères et les larves d’insectes étaient les articles les plus fréquemment consommés, probablement parce que ces articles sont les plus abondants (Fobes et al. 1992). Nos résultats suggèrent également que cette espèce peut être considérée comme un généraliste / opportuniste alimentaire qui se nourrit principalement dans les perchoirs des arbres, et rarement au sol.,
les nématodes présents dans l’estomac et le contenu intestinal sont des parasites courants chez les lézards Anolis (Fobes et al. 1992, Goldberg et Bursey 2002, Lenart et coll. 1994). La charge parasitaire pourrait influencer le succès et le comportement de reproduction des lézards (Suzán-Azpiril et al. 2008), mais cette information n’est pas disponible pour A. ventrimaculatus.
Les différences sexuelles dans le régime alimentaire étaient minimes et étaient principalement liées au nombre de proies, les mâles mangeant probablement des proies plus grandes, ce qui explique le plus faible nombre de proies ingérées par rapport aux femelles, et comme observé dans d’autres anoles (p. ex.,, Perry 1996, Rodríguez 2010, Schoener 1967, 1968). Bien qu’elle n’ait pas été formellement déterminée en raison de la digestion partielle de l’ingesta, des différences dans la taille des proies ont été suggérées par certains objets de très grande taille trouvés uniquement chez les mâles (Montealegre, 1997; Triplehorn et Johnson, 2005).
Les différences mineures observées entre les sexes sont semblables à celles observées chez A. trachyderma (Vitt et al. 2002) et A. aeneus et A. richardii (Simmons et coll. 2005)., Certaines des différences, telles que le nombre de proies ou le pourcentage d’utilisation d’articles, pourraient être liées à des différences dans la disponibilité des proies attribuables à l’utilisation de microhabitats structuraux différents entre les sexes, comme le suggère la variation de la taille du corps et du dimorphisme de forme (Calderón-Espinosa et al. 2013). Cependant, l’utilisation de microhabitats ou la disponibilité des proies chez cette espèce n’a pas été décrite, et les causes qui sous-tendent les différences sexuelles mineures dans le régime alimentaire de l’A. ventrimaculatus demeurent inconnues.,
la variation géographique observée dans l’identité des éléments chez les hommes et chez les femmes pourrait être expliquée comme un effet de taille de l’échantillon, puisque cette variation ne concernait que les éléments, trouvés à de très basses fréquences à chaque localité. Ces éléments ont été observés dans le régime alimentaire d’autres espèces à des fréquences aussi basses (Ardila – Marín et al. 2008, Rodríguez 2010).
le nombre Total de proies variait seulement entre les femelles de différentes localités., La consommation de quantité alimentaire pourrait être liée à l’état de reproduction des individus, car les besoins énergétiques des femelles gravides sont différents de ceux des femelles non gravides (Andrews et Asato, 1977; Losos, 2009; Rodríguez, 2010). Cependant, la plupart des femelles incluses dans cette étude étaient gravides, seulement trois étaient à un stade vitellogène précoce et une était postgravide. Par conséquent, la variation de la quantité de nourriture ingérée par les femelles n’était apparemment pas liée aux besoins énergétiques pour le développement des follicules ou des œufs.,
de plus, les fluctuations saisonnières de la disponibilité des proies pourraient affecter les habitudes alimentaires de ces lézards. Les densités d’insectes et d’autres invertébrés fluctuent habituellement selon les saisons (Régnière, 2009), ce qui affecte la disponibilité des proies pour les lézards, comme décrit pour A. homolequis (Rodríguez, 2010), A. cupreus (Fleming et Hooker, 1975) et d’autres espèces de ce groupe (Aun et al. 1999).
notre étude représente un premier effort pour comprendre les effets du dimorphisme de la taille et de la forme du corps, ainsi que la variation géographique dans un anole andin., Cependant, des données écologiques supplémentaires sont nécessaires pour expliquer la variation alimentaire mineure observée chez cette espèce.
reconnaissances
Cette étude a été rendue possible grâce à l’accès à des spécimens conservés dans la Collection de reptiles de L’Instituto de Ciencias Naturales, UN. Nous remercions C. Sarmiento, G. Amat, E. Flores, J. H. García, D. Martínez et F. Fernández d’avoir aidé à identifier les arthropodes et J. Uribe d’avoir aidé à identifier le contenu végétal des estomacs de lézards. Une revue anonyme a amélioré ce manuscrit.
Andrews RM, Asato T. 1977., Utilisation de l’énergie d’un lézard tropical. Comparatif de la Biochimie et de la Physiologie, 58A: 57-62.
Boulenger GA. 1911. Descriptions de nouveaux reptiles des Andes D’Amérique du Sud, conservés au British Museum. Les annales et le Magazine D’Histoire Naturelle, 8e série, 7 (37): 19-25.
majordome MA, Losos JB. 2002. Dimorphisme sexuel multivarié, sélection sexuelle et adaptation chez les grands lézards Anolis des Antilles. Monographies Écologiques, 72 (4): 541- 559.
Calderón-Espinosa ML, Ortega-León A, Zamora-Abrego JG. 2013., Variation intraspécifique de la taille du corps chez une espèce D’anole des Hautes Terres andines (Anolis ventrimaculatus: Squamata, Dactyloidae). Revista de Biología Tropicale, 61 (1): 255-262.
Eaton JM, Larimer SC, Howard KG, Powell R Parmerlee js Jr.2002. Les densités de Population et la version écologique de la solitaire lézard Anolis gingivinus en Anguilla, Antilles. Caraïbes Journal de la Science, 38 (1): 27-36.
Gutiérrez T, Rumiz D. 2002. Patrones de diversidad de grupos selectos de insectos en el bosque chiquitano y pampas del cerrado de Santiago y Tucavaca, Santa Cruz, Bolivie., Revista Boliviana de Ecología, 11 (1): 37-46.
Henderson EW, Powell R. 2009. Histoire naturelle des reptiles et amphibiens Antillais. Gainesville (Floride): Presses de L’Université de Floride. p. 495.
Lenart LA, Powell R, Parmelee js Jr, Smith DD, Lathrop A. 1994. Régime alimentaire et parasite gastrique D’Anolis armouri, une anole cybotoïde des forêts de pins montagnards du Sud D’Hispaniola. Herpétologique D’Histoire Naturelle, 2 (1): 97-100.
Perry G. 1996., L’évolution du dimorphisme sexuel dans le lézard Anolis polylepis (Iguania): la preuve de la variation intraspécifique dans le comportement de recherche de nourriture et de l’alimentation. Revue canadienne de Zoologie, 74 (7): 1238-1245.
Pianka ER. 1973. La structure des communautés de lézards. Revue annuelle de l’Écologie et la Systématique, 4: 53-74.
Régnière J. 2009. Predicción de la distribución continental de insectos a partir de la fisiología de las especies. Unasylva, 60 (1): 231-232.
Schoener TW. 1967. L’importance écologique du dimorphisme sexuel en taille chez le lézard Anolis conspersus., La Science, 155 (3761): 474-477.
Simpson hein. 1949. Mesure de la diversité. Nature, 163: 688.
Timbres JA, Losos JB, Andrews RM. 1997. Une étude comparative de la densité de la population et de dimorphisme sexuel de taille chez les lézards. Le Naturaliste Américain, 149 (1): 126-135.
Steffen JE. 2009. Une évaluation de l’allométrie de dimorphisme sexuel de taille dans la partie continentale de les anolis. South American Journal of Herpétologie, 4 (3): 245-252.
Suzán-Azpiril G, Galindo-Maldonado F, Ceballos-González G. 2008. La importancia del estudio de enfermedades en la conservation de la faune sylvestre., Veterinaria México, 31 (3): 223 230 En.
Vincent SE, Herrel A. 2007. Fonctionnel et écologique corrélation écologique de dimorphismes dans squamate reptiles. Intégrative et Biologie Comparée, 47 (2): 172-188.
Vitt LJ, Zani PA. 1998. La proie de l’utilisation chez les sympatrique espèces de lézards dans la forêt tropicale de plaine du Nicaragua. Revue d’Écologie Tropicale, 14 (4): 537-559.
Vitt LJ, Avila T, Zani PA, Espósito C. 2002. La vie dans l’ombre: l’écologie de La Anolis trachyderma (Squamata: Polychrotidae) dans Amazonienne de l’Equateur et du Brésil, avec des comparaisons similaires sur le plan écologique les anolis., Copeia, 2002 (2): 275-286.
Vitt LJ, Avila T, Zani PA, Couturier S, Esposito C. 2003b. La vie au-dessus du sol: Ecologie des Anolis fuscoauratus dans la forêt Amazonienne, et les comparaisons avec ses parents les plus proches. Revue canadienne de Zoologie, 81 (1): 142-156.
Zaar JH. 1990. Analyse biostatistique. 4e ed. Upper Saddle River, Nueva Jersey: Prentice-Hall Press. p. 663.