disulfure de carbone propriétés chimiques,utilisations,Production
utilisations
fabrication de fibres de viscose de rayonne et de film de cellophane; solvant pour lipides, soufre, caoutchouc, phosphore, huiles, résines et cires; insecticide.
propriétés chimiques
le disulfure de carbone (bisulfure de carbone; CS2; CASRN 75-15-0), sous sa forme pure, est un liquide incolore qui s’évapore facilement à température ambiante, avec une odeur aromatique douce similaire à celle du chloroforme., Dans sa forme commerciale et réactive impure, cependant, le disulfure de carbone est un liquide jaunâtre avec une odeur de foulsmelling. Il peut être détecté par odeur à environ 1 ppm, mais l’odorat se fatigue rapidement et, par conséquent, l’odeur ne sert pas de bonne propriété d’avertissement. Il a une pression de vapeur de 297 mmHg et une solubilité dans l’eau en poids de 0,3% à 20 °C (68 °F). Une fois que le disulfure de carbone est dans l’air, il se décompose en substances plus simples quelques jours après sa libération (OEHHA, 2001).,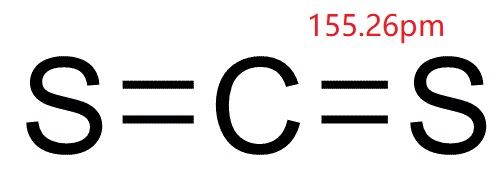
Propriétés physiques
liquide clair, incolore à jaune pâle; odeur éthérée lorsqu’elle est pure. Les qualités techniques ont une forte odeur nauséabonde,pourrie et semblable à celle du radis. Leonardos et coll. (1969) ont signalé un seuil d’odeur dans l’air de 210 ppbv.
utilisations
le disulfure de carbone est utilisé dans la fabrication de rayonne de cellulose régénérée, de cellophane, de désinfectants pour le sol et de tubes à vide électroniques. D’autres utilisations majeures sont dans la production de tétrachlorure de carbone, de xanthates,de thiocyanates, d’adhésifs pour contreplaqué et d’accessoires en caoutchouc., Il est également employé comme dissolvant et éluant d’Asan pour les produits organiques adsorbés sur l’analyse d’air de charcoalin.
utilisations
le disulfure de carbone est utilisé comme matière première dans la production de rayonne, de cellophane, de semi-conducteurs et de tétrachlorure de carbone, et pour fabriquer certains pesticides. Il est utilisé comme solvant industriel et intermédiaire chimique pour dissoudre le caoutchouc pour produire des pneus (ATSDR, 1996), ainsi que dans la fumigation des grains, la recherche en chimie analytique, le dégraissage, le nettoyage à sec et l’extraction d’huile (Finkel et al., 1983)., Les sources naturelles de disulfure de carbone comprennent la haute mer, les zones côtières à forte activité biologique, la réduction microbienne des sulfates dans le sol, les marais et certaines plantes supérieures où la source de disulfure de carbone est les racines des arbres (Carroll, 1985; Khalil et Rasmussen, 1984).
auparavant, le disulfure de carbone était utilisé comme pesticide, où il était généralement mélangé avec du tétrachlorure de carbone dans un mélange 20/80, respectivement. Ce mélange a été utilisé pour exterminer les insectes et les rongeurs de wagons entiers de blé, de maïs, de seigle et d’autres céréales (Peters et al., 1988)., Les fumigateurs à grains peuvent être fortement intoxiqués et peuvent être exposés de façon chronique au disulfure de carbone. Par conséquent, à la fin des années 1980, tous les pesticides contenant du disulfure de carbone comme ingrédient actif ont été annulés par L’Environmental Protection Agency des États-Unis (U. S. EPA) (U. S. EPA, 1999).
utilise
dans la fabrication de rayonne, de tétrachlorure de carbone, de xanthogénates, de désinfectants pour le sol, de tubes à vide électroniques. Solvant pour phosphore, soufre, sélénium, brome, iode, graisses, résines, caoutchoucs.,
préparation
le disulfure de carbone est fabriqué en chauffant de la vapeur de soufre avec du charbon de bois et en condensant les vapeurs du composé formé. Alternativement, il peut être obtenu en chauffant du soufre avec du gaz naturel ou des fractions de pétrole. Au lieu de soufre, H2S peut être utilisé. La réaction se produit à des températures très élevées. Le produit obtenu dans ces réactions peut contenir des impuretés soufrées. Le disulfure de carbone est purifié par distillation.,
Description générale
le disulfure de carbone pur est un liquide incolore avec une odeur agréable semblable à celle du chloroforme, tandis que le disulfure de carbone impur est un liquide jaunâtre avec une odeur désagréable, comme celle des radis pourris. L’exposition au disulfure de carbone se produit dans les lieux de travail industriels. Les Industries associées aux usines de gazéification du charbon libèrent davantage de disulfure de carbone, de sulfure de carbonyle et de sulfure d’hydrogène. Le disulfure de carbone est utilisé en grande quantité comme produit chimique industriel pour la production de fibres de rayonne viscose., En fait, la principale source de pollution de l’environnement à l’intérieur et à l’extérieur par le disulfure de carbone est causée par les émissions rejetées dans l’air par les usines de viscose.
Air& réactions de L’eau
hautement inflammable. Insoluble dans l’eau.
profil de réactivité
le disulfure de carbone a une température d’auto-inflammation extrêmement basse (125°C). Peut s’enflammer ou même exploser lorsqu’il est chauffé. On sait que la vapeur ou le liquide s’enflamme au contact des conduites de vapeur, en particulier s’il est rouillé . Risque d’Explosion lorsqu’il est exposé à la flamme, à la chaleur, aux étincelles ou au frottement., Les mélanges contenant du tétraoxyde de lithium, de sodium, de potassium ou de dinitrogène peuvent exploser en cas de choc. Réaction potentiellement explosive avec l’oxyde d’azote, le chlore, l’acide permanganique(agents oxydants forts). La vapeur s’enflamme au contact de la poudre d’aluminium ou du fluor. Réagit violemment avec les azotures, l’éthylamine l’éthylènediamine, l’éthylène imine. Émet des fumées hautement toxiques d’oxydes de soufre lorsqu’il est chauffé à la décomposition . L’amide de Sodium forme un gaz H2S toxique et inflammable avec CS2. (714)
danger
un poison. Toxique par absorption cutanée. Risque d’incendie et d’explosion hautement inflammable et dangereux, peut être enflammé par friction., Limites explosives dans l’air1-50%. Cancérigène douteux. Système nerveux périphérique dépréciation.
danger pour la santé
bien que le disulfure de carbone présente une faible toxicité chez la plupart des animaux de laboratoire, son toxicité est relativement plus élevée chez l’homme. La voie d’exposition primaire est l’inhalation de vapeurs. Il peut également entrer dans le corps à traversabsorption de la peau. L’effet toxique d’une exposition unique est la narcose. Une exposition répétée provoque des maux de tête, des étourdissements, de la fatigue, de la nervosité, de l’insomnie, de la psychose, de l’irritation, des tremblements,une perte d’appétit, une indigestion et des troubles gastriques., Les symptômes ci-dessus peuvent se manifester chez l’homme après quelques mois d’exposition quotidienne de 4 heures à 150 ppm. Une concentration inférieure à 30 ppm ne produit aucun effet toxique notable. Une exposition de 15 minutes à 5000 ppm de disulfure de carbone dans l’air peut être fatale pour l’homme. L’Ingestion de 5-10 mL de Lele liquide peut être fatal. La DL50 orale inrats est de l’ordre de 3000 mg / kg.Chapman et coll. (1991) ont signalé des tremblements des doigts chez l’homme similaires à la maladie de Parkinson idiopathique résultant d’une exposition chronique aux pesticides à base de disulfure de carbone., Des effets neurotoxiques similaires du pesticide disulfirame ont déjà été attribués à son métabolite,CS2 (Rainey Jr., 1977). Les appuis et coll. (2005) ont mené des études de neurotoxicité par inhalation de CS2 sur le cordon nerveux central du système nerveux central et sur les portions distales des axones myélinisés longs du système nerveux périphérique chez des rats F344. Les auteurs ont observé que CS2 produisait une réticulation intra – et intermoléculaire des protéines in vivo. Une telle liaison covalente dans les protéines neurofilamentaires priorto l’apparition de lésions a contribué aux gonflements axonaux neurofilamenteux.Chou et coll., (2005) ont étudié la toxicité cutanée induite par CS2 chez la souris et les altérations de la perméabilité épidermique conduisant à des changements physiologiques et pathologiques de l’exposition actuelle au CS2. Les auteurs ont postulé deux voies mécanistes pour expliquer les altérations épidermiques induites par le CS2, l’une entraînant une déplétion lipidique intercellulaire et l’autre une lésion kératinocytaire.
risque D’incendie
température d’allumage dangereusement basse: 212F. les vapeurs peuvent être enflammées par contact avec une ampoule ordinaire, lorsqu’elles sont chauffées à la décomposition, le disulfure de carbone émet des fumées hautement toxiques d’oxydes de soufre., Lorsqu’il est chauffé à la décomposition, émet des fumées hautement toxiques d’oxydes de soufre et peut réagir vigoureusement avec les matériaux oxydants. Évitez l’air, la rouille, les halogènes, les azotures métalliques, les métaux, les oxydants; lorsqu’ils sont exposés à la chaleur ou à la flamme réagit violemment avec l’aluminium, le chlore, les azotures, l’hypochlorite, l’éthylamine diamine, l’éthylène imine, le fluor, les azotures métalliques de lithium, de potassium, de césium, de rubidium et de sodium, les oxydes Se décompose sur la position debout pendant une longue période.,
inflammabilité et explosibilité
le disulfure de carbone est extrêmement inflammable et présente un risque d’incendie dangereux (NFPArating = 3). Il a une pression de vapeur élevée et une température d’autoignitiontemperature extrêmement basse. Sa vapeur est plus lourde que l’air et peut parcourir une distance considérable jusqu’à une source d’allumage et de retour de flamme. La vapeur forme des mélanges explosifs dans l’air àconcentrations de 1,3 à 50%. Le disulfure de carbone peut être enflammé par des surfaces chaudes telles que des bains de vapeur qui ne constitueraient généralement pas une source d’inflammation pour d’autres vapeurs inflammables., La rouille (oxyde de fer) peut augmenter la probabilité d’inflammation par chaudsurfaces. Les feux de disulfure de carbone doivent être éteints avec du CO2 ou des extincteurs chimiques secs.
profil de sécurité
un poison humain par voie non spécifiée. Légèrement toxique pour l’homme par inhalation. Un poison expérimental par voie intrapéritonéale. De l’homme sur la reproduction effets sur la spermatogenèse par inhalation. Effets tératogènes et reproductifs expérimentaux. Données de mutation humaine rapportées., Le principal effet toxique est sur le système nerveux central, agissant comme narcotique et anesthésique en cas d’intoxication aiguë avec décès suite à une insuffisance respiratoire. Dans l’empoisonnement chronique, l’effet sur le système nerveux est l’un des dommages centraux et périphériques, qui peuvent être permanents si les dommages ont été graves. Liquide inflammable. Un danger d’incendie dangereux lorsqu’il est exposé à la chaleur, à la flamme, aux étincelles, au frottement ou à des matériaux oxydants. Risque d’explosion grave lorsqu’il est exposé à la chaleur ou à la flamme. Inflammation et réaction potentiellement explosive lorsqu’il est chauffé au contact de la rouille ou du fer., Mixtures with sodium or potassiumsodum alloys are powerful, shock-sensitive explosives. Explodes on contact with permanganic acid. Potentially explosive reaction with nitrogen oxide, chlorine (catalyzed by iron). Mixtures with dinitrogen tetraoxide are heat-, spark-, and shocksensitive explosives. Reacts with metal azides to produce shockand heat-sensitive, explosive metal azidodtthioformates. Aluminum powder ignites in CS2 vapor. The vapor ignites on contact with fluorine., Réagit violemment avec les azotures, CsN3, Cl0, éthylamine diamine, éthylène imine, PB(N3)2, LiN3, (H2SO4 + permanganates), KN3, RbN3, NaN3, complexes phénylcoppertriphénylphosphine. Incompatible avec l’air, les métaux, les oxydants. Pour combattre le feu, utilisez de l’eau, du CO2, des produits chimiques secs, du brouillard, du brouillard. Lorsqu’il est chauffé à la décomposition, il émet des fumées hautement toxiques de SO,.,
Exposition Potentielle
le disulfure de carbone est utilisé dans la fabrication de rayonne de viscose; sels d’ammonium; tétrachlorure de carbone; carbanilide, génates de xantho; agents de flottation; soildisinfectants; colorants; tubes à vide électroniques; verre optique;Peintures, émaux, décapants de peinture; vernis; décapants de vernis; suif, textiles, explosifs; carburant de fusée; mastic; conservateurs et ciment de caoutchouc; cires, laques,camphre, résines et caoutchouc vulcanisé à froid., Il est également utilisé dans le dégraissage, l’analyse chimique, la galvanoplastie, la fumigation des grains, l’extraction d’huile et le nettoyage à sec. Il est largement utilisé comme intermédiaire pesticide.
Source
identifiée parmi 139 composés volatils identifiés dans le cantaloup (Cucumis melo var.qui réticule cv. Sol Real) en utilisant une méthode automatisée de microextraction en phase solide à espace de tête rapide (Beaulieu et Grimm, 2001).
devenir Environnemental
Chimique / Physique. Le disulfure de carbone s’hydrolyse dans des solutions alcalines en dioxyde de carbone et en disulfure d’hydrogène (Peyton et al., 1976).,
dans une solution alcaline aqueuse contenant du peroxyde d’hydrogène, du dithiopercarbonate, du sulfure, du soufre élémentaire et des polysulfures peuvent se former (Elliott, 1990). Dans une solution alcaline aqueuse (pH ≥8), le disulfure de carboneréacté avec du peroxyde d’hydrogène formant des ions sulfate et carbonate. Cependant, lorsque thepH est abaissé à 7-7.4, du soufre colloïdal se forme (Adewuyi et Carmichael, 1987).
Une solution Anaqueuse contenant du disulfure de carbone réagit avec l’hypochlorite de sodium en formantle dioxyde de carbone, l’acide sulfurique et le chlorure de sodium (Patnaik, 1992)., Forme un hémihydratequi se décompose à -3°C (Keith et Walters, 1992).Fumigantsburns agricoles avec une flamme bleue libérant du dioxyde de carbone et du dioxyde de soufre (Windholz et al.,1983). Émet des oxydes de soufre très toxiques lorsqu’ils sont chauffés à la décomposition (Lewis, 1990).Le disulfure de carbone s’oxyde dans la troposphère en produisant du sulfure de carbonyle. Les demi-vies atmosphériques du disulfure de carbone et du sulfure de carbonyle ont été estimées à environ 2 ans et 13 jours, respectivement (Khalil et Rasmussen, 1984).,
stockage
le carbondisulfure ne doit être utilisé que dans des zones exemptes de sources d’inflammation (y compris les plaques chauffantes,les ampoules à incandescence et les Bains de vapeur), et cette substance doit être stockée dans des récipients métalliques hermétiquement fermés dans des zones séparées des oxydants.
expédition
UN1131 disulfure de carbone, classe de danger: 3; étiquettes: 3-Liquide inflammable, 6.1-matériaux toxiques.,
méthodes de Purification
agitez – le pendant 3 heures avec trois portions de solution de KMnO4 (5g/L), deux fois pendant 6 heures avec du mercure (pour éliminer les impuretés sulfurées) jusqu’à ce qu’il n’y ait plus d’assombrissement de l’interface, et enfin avec une solution de HgSO4 (2,5 g/L) ou Séchez – le avec CaCl2, MgSO4 ou CaH2 (avec un séchage supplémentaire par reflux sur P2O5), suivi d’une distillation fractionnée à la lumière diffuse. Métaux alcalins ne peuvent pas être utilisés comme agents de séchage. Il a également été purifié en se tenant avec du brome (0.,5ml / L) pendant 3-4hours, secouant rapidement avec la solution de KOH, puis les tournures de cuivre (pour enlever le brome non réagi), et le séchage avec CaCl2. CS2 est très toxique et très inflammable. Travailler dans un bon fumehood. De petites quantités de CS2 ont été purifiées (y compris l’élimination des hydrocarbures) par agitation mécanique d’un échantillon de 45-50g avec une solution de 130g de sulfure de sodium dans 150ml de H2O pendant 24 heures à 35-40o. la solution aqueuse de thiocarbonate de sodium est séparée de CS2 qui n’a pas réagi, puis précipitée avec 140g de sulfate de cuivre dans 350g d’eau, avec refroidissement., Après avoir filtré le thiocarbonate de cuivre, il est décomposé en y faisant passer de la vapeur. Le distillat est séparé de H2O et distillé à partir de P2O5.
incompatibilités
incompatibles avec les oxydants (chlorates,nitrates, peroxydes, permanganates, perchlorates, chlore,brome, fluor, etc.); contact peut provoquer des incendies ou des explosions. Tenir à l’écart des matériaux alcalins, des bases fortes,des acides forts, des oxoacides, des époxydes. Également incompatible avecmétaux chimiquement actifs (tels que le sodium, le potassium, le zinc),azotures, amines organiques, halogènes. Peut se décomposer de manière explosive lors d’un choc, d’une friction ou d’une commotion cérébrale., Peut exploser onheating. La substance peut s’enflammer spontanément au contactavec de l’air et au contact de surfaces chaudes, produisant des fumées toxiques de dioxyde de soufre. Réagit violemment avec les oxydants pour produire des oxydes de soufre et de monoxyde de carbone, et causer un risque d’incendie et d’explosion. Attaque certaines formes de plastique,de caoutchouc et de revêtement.
élimination des déchets
ce composé est un liquide très inflammable qui s’évapore rapidement. Il brûle avec un Blueflame au dioxyde de carbone (inoffensif) et au dioxyde de soufre.Le dioxyde de soufre a une forte odeur suffocante; 1000 ppm dans l’air est mortel pour les rats., Le liquide pur présente un risque d’incendie aigu etd’explosion. La procédure d’élimination suivante est suggérée: tout l’équipement ou les surfaces de contact devraient begrounded pour éviter l’inflammation par des charges statiques. Absorber sur la vermiculite, le sable ou les cendres et couvrir d’eau. Transférez l’eau dans des seaux dans une zone ouverte. Allumez de distanceavec un sentier excelsior. Si la quantité est importante, le disulfure de Carbonepeut être récupéré par distillation et reconditionné pour être utilisé.
précautions
lors de la manipulation de disulfi de carbone, les travailleurs professionnels ont besoin de vêtements appropriés, d’une protection oculaire et d’une protection respiratoire., Les travailleurs devraient utiliser le produit chimique sous la direction formée. Au contact des yeux, verser immédiatement de grandes quantités d’eau. En cas de contact avec la peau, le travailleur doit retirer rapidement les vêtements contaminés et appeler immédiatement des soins médicaux