aperçu
La β-oxydation des acides gras est un processus en plusieurs étapes par lequel les acides gras sont décomposés par divers tissus pour produire de l’énergie. Les acides gras pénètrent principalement dans une cellule via des transporteurs de protéines d’acides gras à la surface de la cellule . Les transporteurs d’acides gras comprennent la translocase d’acide gras (FAT / CD36), les protéines de transport d’acides gras spécifiques aux tissus (FATP) et la protéine de liaison d’acides gras liée à la membrane plasmique (FABPpm). Une fois à l’intérieur de la cellule, un groupe CoA est ajouté à l’acide gras par l’acyl-CoA synthase grasse (FACS), formant l’acyl-CoA à longue chaîne., Carnitine palmitoyltransférase 1 (CPT1) la conversion de l’acyl-CoA à longue chaîne en acylcarnitine à longue chaîne permet au fragment d’acide gras d’être transporté à travers la membrane mitochondriale interne via la carnitine translocase (CAT), qui échange les acylcarnitines à longue chaîne contre la carnitine. Une membrane mitochondriale interne CPT2 convertit alors l’acylcarnitine à longue chaîne en acyl-CoA à longue chaîne. L’acyl-CoA à longue chaîne entre dans la voie de β-oxydation des acides gras, ce qui entraîne la production d’un acétyl-CoA à partir de chaque cycle de β-oxydation des acides gras., Cet acétyl-CoA entre ensuite dans le cycle de l’acide tricarboxylique mitochondrial (TCA). Le NADH et le FADH2 produits par la β-oxydation des acides gras et le cycle TCA sont utilisés par la chaîne de transport d’électrons pour produire de l’ATP. La Figure 1 donne un aperçu de l’oxydation des acides gras.
la Figure 1. Oxydation des acides gras aperçu
la β-oxydation des acides gras est le processus par lequel les acides gras sont décomposés pour produire de l’énergie. Les acides gras pénètrent principalement dans une cellule via des transporteurs de protéines d’acides gras à la surface de la cellule., Une fois à l’intérieur, FACS ajoute un groupe de CoA à l’acide gras. CPT1 convertit alors l’acyl-CoA à longue chaîne en acylcarnitine à longue chaîne. La fraction d’acide gras est transportée par CAT à travers la membrane mitochondriale interne. CPT2 convertit alors l’acylcarnitine à longue chaîne en acyl-CoA à longue chaîne. L’acyl-CoA à longue chaîne peut alors entrer dans la voie de β-oxydation des acides gras, entraînant la production d’un acétyl-CoA à partir de chaque cycle de β-oxydation. Cet acétyl-CoA entre alors dans le cycle de TCA., Le NADH et le FADH2 produits à la fois par β-oxydation et par le cycle TCA sont utilisés par la chaîne de transport d’électrons pour produire de l’ATP.
rôle de l’apport en acides gras dans la régulation de la β-oxydation des acides gras
transport cellulaire des acides gras:
Il y a eu des efforts considérables ces dernières années pour élucider les mécanismes par lesquels les acides gras sont absorbés par les cellules, en particulier pour déterminer si les acides gras sont transportés à travers la membrane cellulaire par simple diffusion ou si ce transport est facilité par des protéines associées à la membrane., Bien que divers résultats soutiennent les deux méthodes de transport, le transport par les protéines associées à la membrane est considéré comme le moyen prédominant d’absorption des acides gras dans les cellules . Diverses protéines membranaires qui facilitent l’absorption des acides gras cellulaires ont été identifiées. Les transporteurs d’acides gras associés à la membrane CD36 / FAT, FABPpm et FATPs diffèrent par leur poids moléculaire et leur degré de modification post-traductionnelle . Stremmel et coll. rapporté que les anticorps dirigés contre le foie de rat FABPpm inhibent l’absorption des acides gras par les hépatocytes, les adipocytes et les cardiomyocytes de 50 à 75%., Ce résultat suggère qu’une partie importante de l’absorption des acides gras dépend du transport médié par les protéines dans différents types de cellules .
Schaffer et Lodish ont découvert le FATP en utilisant une stratégie de Clonage d’expression dans les adipocytes . L’expression de cette protéine membranaire intégrale de 63 kDa dans une lignée cellulaire fibroblastique stable a entraîné une augmentation de 3 à 4 fois du transport des acides gras à longue chaîne. L’Identification de ce premier FATP a conduit à la découverte de plusieurs autres isoformes de FATP (FATP1-6) . FATP1 est principalement exprimé dans le cœur et les muscles squelettiques ., FATP2 et FATP5 sont exprimés principalement dans le foie, où ils sont impliqués dans le métabolisme des lipides hépatiques en association avec l’acyl-CoA synthétase. FATP4 est essentiel pour l’absorption des lipides alimentaires et joue un rôle critique dans la structure et la fonction normales de la peau. À ce jour, il a été démontré que FATP3 et FATP6 ont peu ou pas de fonction de transport d’acides gras .
le rôle de la protéine membranaire CD36/FAT dans l’absorption des acides gras et la β-oxydation chez les mammifères a été largement étudié., CD36 / FAT est une protéine membranaire translocase d’acide gras de 88 kDa exprimée proportionnellement au taux d’oxydation des acides gras dans le tissu musculaire (par exemple, elle est exprimée plus dans le cœur que dans le muscle squelettique) . CD36 / FAT est impliqué dans l’angiogenèse et l’inflammation, ainsi que dans le métabolisme des lipides. La Transfection de fibroblastes avec CD36 / FAT a entraîné une augmentation des taux d’absorption d’acides gras . Contrairement au FATP, le CD36 / FAT a la capacité de se déplacer entre les endosomes intracellulaires et la membrane plasmique des cellules, ce qui permet au CD36/FAT de jouer un rôle critique dans la régulation de l’absorption des acides gras., L’insuline et la contraction musculaire peuvent stimuler la translocation CD36/FAT des magasins intracellulaires à la membrane plasmique, ce qui conduit à une absorption accrue et à une β-oxydation des acides gras. L’activation de FoxO1 peut mener à la translocation CD36/FAT qui a comme conséquence la β-oxydation accrue d’acide gras avec l’accumulation de triacylglycérol . Ceci suggère un rôle significatif de la signalisation intracellulaire dans la fonction CD36/FAT.
le mécanisme exact induisant la translocation CD36/FAT est encore inconnu., Cependant, on suppose que L’activation de la protéine kinase AMP-activée (AMPK) et l’état énergétique des cellules musculaires peuvent participer à la réponse de translocation CD36/FAT . De plus, la stimulation de la protéine kinase C (PKC) dans les cardiomyocytes induit une translocation CD36/FAT, indiquant un rôle possible pour le calcium dans le processus de translocation . D’autre part, l’inhibition du récepteur kinase de signalisation extracellulaire (ERK) peut bloquer la translocation CD36/FAT induite par contraction musculaire ., La modification Post-traductionnelle de CD36 / FAT par ubiquitination peut également réguler les niveaux de protéines intracellulaires de CD36 / FAT en ciblant la protéine pour la dégradation. Par conséquent, l’insuline augmente la disponibilité de CD36/FAT pour la translocation par inhibition de l’ubiquitination. Cependant, les acides gras favorisent l’ubiquitination, ce qui conduit à la dégradation CD36/FAT .
estérification des acides gras en acyl-CoA:
un acide gras doit être converti en acyl-CoA gras pour qu’il pénètre dans les mitochondries et soit oxydé ., L’enzyme responsable de l’estérification des acides gras en acyl-CoA gras à longue chaîne est FACS. Pour cette réaction, FACS consomme l’équivalent de deux ATP. Une autre enzyme, la thioestérase cytosolique (CTE), peut éliminer le CoA en convertissant l’acyl-CoA gras en un acide gras. L’acyl-CoA gras peut être converti en acyl carnitine, ce qui lui permet d’être transporté dans les mitochondries et d’entrer dans la β-oxydation des acides gras ou d’être converti en métabolites lipidiques (triacylglycérol, diacylglycérol, céramide, etc.).,
l’acétyl-CoA carboxylase, malonyl-CoA décarboxylase, malonyl-CoA axe:
L’acétyl-CoA carboxylase (ACC) est une enzyme centrale impliquée dans la β-oxydation des acides gras et la biosynthèse des acides gras. ACC catalyse la carboxylation de l’acétyl-CoA produisant du malonyl-CoA, qui peut être utilisé par la synthase des acides gras pour la biosynthèse des acides gras . Bien que le malonyl-CoA soit utilisé comme substrat pour la biosynthèse des acides gras, le malonyl-CoA est également un inhibiteur puissant de l’absorption des acides gras mitochondriaux secondaire à l’inhibition de CPT1 (Figure 2) ., Il existe deux formes D’ACC, un isoforme de 265 kDa ACC1, qui est fortement exprimé dans le foie et le tissu adipeux, et un isoforme de 280 kDa ACC2 qui est plus spécifique aux organes hautement métaboliques tels que le muscle squelettique et le cœur . L’AMPK joue un rôle majeur dans la régulation de L’ACC1 et de L’ACC2 en phosphorylant et en inhibant l’activité de L’ACC. Dans les situations de demande énergétique accrue, L’AMPK est activé, où il phosphoryleet inactive les deux isoformes D’ACC (Figure 3). L’inhibition de L’ACC2 peut entraîner une augmentation de la β-oxydation des acides gras, tandis que la biosynthèse des acides gras diminue lorsque L’ACC1 est inhibée .,
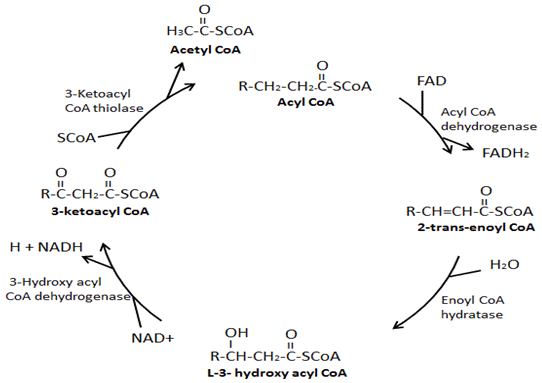
la Figure 2. La voie de β-oxydation des acides gras
Les quatre principales enzymes impliquées dans la β-oxydation sont: l’acyl-CoA déshydrogénase, l’énoyl-CoA hydratase, l’hydroxy-acyl-CoA déshydrogénase et la cétoacyl-CoA thiolase. L’Acyl-CoA déshydrogénase crée une double liaison entre les deuxième et troisième carbones du groupe CoA sur l’acyl-CoA et, dans le processus, produit un FADH2., Ensuite, l’énoyl-CoA hydratase élimine la double liaison qui vient de se former, en ajoutant un groupe hydroxyle au troisième carbone du groupe CoA et un hydrogène sur le deuxième carbone du groupe CoA. Hydroxyacyl-CoA déshydrogénase élimine l’hydrogène dans le groupe hydroxyle juste attaché et dans le processus produit un NADH. Dans la dernière étape, la cétoacyl-COA thiolase attache un groupe CoA au troisième carbone descendant du groupe CoA, ce qui entraîne la formation de deux molécules, un acétyl-CoA et un acyl-CoA qui sont deux carbones plus courts.,
la régulation à Long terme de l’ACC dépend de la régulation de son expression des gènes. Plusieurs facteurs transcriptionnels peuvent réguler L’expression du gène ACC, y compris la protéine de liaison des éléments régulateurs de stérols (SREBP1a et SREBP1c) et la protéine de liaison des éléments de réponse glucidique (ChREBP) . Le srebp est régulé par l’insuline, qui favorise le clivage et la translocation du réticulum endoplasmique SREBP1c vers le noyau, ce qui entraîne une stimulation de l’expression de L’ACC., De plus, les facteurs de transcription γ coactivateur 1 (PGC-1) α Et β Du récepteur activé par le proliférateur de peroxysome peuvent stimuler l’expression de SREBP1a et de srebp1c, qui ont tous deux un rôle vital dans la lipogenèse. L’expression du ChREBP peut être induite par des concentrations élevées de glucose, ce qui entraîne l’activation du ChREBP favorisant L’expression de L’ACC1 et de l’acide gras synthase . Le facteur respiratoire nucléaire-1 (NRF-1) est un modulateur principal de l’expression des protéines mitochondriales et de la biogenèse mitochondriale, qui sont tous deux importants pour une capacité d’oxydation β des acides gras mitochondriaux plus élevée ., Par exemple, Adam et coll. a montré que la surexpression de NRF-1 entraîne une inhibition de l’activité du promoteur du gène ACC2 dans le cœur des mammifères, ce qui améliore les taux d’oxydation β des acides gras mitochondriaux, favorisant ainsi la capacité énergétique intracellulaire globale .
La Malonyl-CoA décarboxylase (MCD) est l’enzyme responsable de la décarboxylation du malonyl-CoA en acétyl-CoA . Généralement, le niveau de malonyl-CoA est diminué lorsque l’activité MCD est augmentée, ce qui entraîne un taux élevé d’oxydation des acides gras., Il a été rapporté que les protéines kinases qui phosphorylent et inhibent L’ACC pourraient activer la MCD . Cependant, la MCD semble être principalement réglementée par des moyens transcriptionnels (discutés plus loin). Par conséquent, MCD et ACC semblent travailler en harmonie pour réguler le pool de malonyl-CoA qui peut inhiber CPT1 .
carnitine palmitoyl transférase mitochondriale (CPT):
L’isoforme CPT, CPT1, réside sur la surface interne de la membrane mitochondriale externe et est un site majeur de régulation de l’absorption des acides gras mitochondriaux ., Comme mentionné, CPT1 est puissamment inhibé par le malonyl-CoA, le produit de L’ACC Qui se lie au côté cytosolique de CPT1. Les mammifères expriment trois isoformes de CPT1, qui sont codées par différents gènes. L’isoforme hépatique (CPT1a), l’isoforme musculaire (CPT1ß) et une troisième isoforme de CPT1 (CPT1c), qui est principalement exprimée dans le cerveau et les testicules . Plus précisément, le cœur exprime deux isoformes de CPT1, une isoforme de 82 KDa (CPT1a) et l’isoforme prédominante de 88 kDa (CPT1ß) (qui a la sensibilité la plus élevée à l’inhibition du malonyl-CoA)., L’insuline et l’hormone thyroïdienne peuvent réguler la sensibilité de CPT1a dans le foie; cependant, L’isoforme CPT1ß n’est pas affectée . Des études antérieures ont rapporté que les niveaux de malonyl-CoA sont inversement corrélés avec les taux d’oxydation β des acides gras . De plus, des études sur des souris knockout ACC2 suggèrent deux pools cellulaires distincts de malonyl-CoA, le malonyl-CoA produit par ACC1 (utilisé principalement pour la lipogenèse), et un pool cytosolique de malonyl-CoA produit par ACC2 impliqué dans la régulation du CPT1 et de la β-oxydation des acides gras .,
β-oxydation des acides gras mitochondriaux
la voie de β-oxydation des acides gras:
La β-oxydation des acides gras est le processus de décomposition d’une molécule d’acyl-CoA à longue chaîne en molécules d’acétyl-CoA. Le nombre d’acétyl-CoA produit dépend de la longueur en carbone de l’acide gras oxydé. Ce processus implique une variété d’enzymes, les quatre principales enzymes impliquées dans la β-oxydation des acides gras étant, dans l’ordre, l’acyl-CoA déshydrogénase, l’énoyl-CoA hydratase, l’hydroxyacyl-CoA déshydrogénase et la cétoacyl-CoA thiolase (Figure 3) ., À la fin de chaque cycle de β-oxydation, deux nouvelles molécules sont formées, un acétyl-CoA et un acyl-CoA qui est deux carbones plus court. De plus, pendant la β-oxydation, du NADH et du FADH2 sont formés. Un FADH2 est produit au cours de la réaction catalysée par l’acyl-CoA déshydrogénase. Un NADH est produit au cours de la réaction catalysée par l’hydroxyacyl-CoA déshydrogénase. Le FADH2 et le NADH produits au cours du processus de β-oxydation des acides gras sont utilisés par la chaîne de transport d’électrons pour produire de l’ATP., Il existe différentes isoformes de ces enzymes de β-oxydation, qui ont des affinités différentes pour différentes longueurs de chaîne d’acides gras. Par exemple, il existe une acyl-CoA déshydrogénase à très longue chaîne, une acyl-CoA déshydrogénase à longue chaîne, une acyl-CoA déshydrogénase à chaîne moyenne et une acyl-CoA déshydrogénase à chaîne courte. Fait intéressant, l’énoyl-CoA hydratase, l’hydroxyacyl-CoA déshydrogénase et les isoformes cétoacyl-CoA spécifiques aux acides gras à longue chaîne forment un complexe enzymatique sur la membrane mitochondriale interne.
la Figure 3., Principaux sites de régulation de la β-oxydation des acides gras
la β-oxydation des acides gras est régulée à plusieurs niveaux. Cette figure montre certaines des façons dont la β-oxydation des acides gras est régulée. 1. La régulation peut se produire au niveau de l’entrée des acides gras dans la cellule. AMPK, PKC et PPARy régulent positivement L’activité de CD36 / FATP. 2. La régulation se produit également via la régulation des niveaux d’acétyl-CoA et de malonyl-CoA. L’AMPK inhibe L’ACC, entraînant une augmentation des niveaux d’acétyl-CoA/une diminution des niveaux de malonyl-CoA et une augmentation de l’oxydation des acides gras. Le Malonyl-CoA inhibe l’oxydation des acides gras en inhibant CPT1., 3. La régulation transcriptionnelle est également impliquée dans la régulation de la β-oxydation des acides gras. PGC-1α, un corégulateur de facteur de transcription, et le facteur de transcription PPARa agissent dans le noyau pour augmenter la transcription des gènes mitochondriaux, des gènes d’utilisation d’acide gras, et d’autres facteurs de transcription.
Auxiliaire enzymes sont nécessaires pour la β-oxydation des acides gras insaturés et les acides gras à chaîne. Les acides gras impairs sont décomposés par β-oxydation en molécules d’acétyl-CoA et de propionyl-CoA., Bien que le propionyl-CoA puisse être métabolisé par d’autres voies, il est principalement métabolisé dans la cellule en succinyl-CoA par trois enzymes (propionyl-CoA carboxylase, méthylmalonyl-CoA épimérase et méthylmalonyl-CoA mutase) . Ce succinyl-CoA peut alors entrer dans le cycle de TCA. Comparés aux acides gras pairs, les acides gras impairs se produisent rarement dans la nature . Les deux enzymes auxiliaires, l’énoyl-CoA isomérase et la 2,4-diénoyl-CoA réductase sont nécessaires à l’oxydation complète des acides gras insaturés ., Au cours du cycle de β-oxydation dans lequel la liaison cis-double Commence sur le troisième carbone de l’acyl-CoA, la première étape consiste à isomériser l’énoyl-CoA isomérase avant que l’énoyl-CoA hydratase, et les deux autres enzymes, puissent agir sur l’acyl-CoA. Une double liaison sur un carbone Pair nécessite les deux enzymes auxiliaires. Une fois que la double liaison est sur le quatrième carbone de l’acyl-CoA au début d’un cycle de β-oxydation, il commence à être oxydé. Suite à l’action de l’acyl-CoA déshydrogénase, la 2,4-diénoyl CoA réductase agit sur l’acyl-CoA suivi de l’énoyl-CoA isomérase., L’énoyl-CoA hydratase agit alors sur l’acyl-CoA et le processus reprend son ordre normal.
le contrôle Allostérique de l’acide gras β-oxydation:
L’activité des enzymes, des acides gras β-oxydation est affectée par le niveau des produits de leurs réactions . Chacune des enzymes de β-oxydation est inhibée par l’intermédiaire gras spécifique d’acyl-CoA qu’elle produit . Fait intéressant, la 3-cétoacyl-CoA peut également inhiber l’énoyl-CoA hydratase et l’acyl-CoA déshydrogénase . la β-oxydation peut également être régulée allostériquement par le rapport NADH / NAD+ et le niveau acétyl-CoA/CoA., Une augmentation des rapports NADH/NAD+ ou acétyl-CoA/CoA entraîne une inhibition de la β-oxydation des acides gras. Il a été spécifiquement démontré que les augmentations du rapport acétyl-CoA/CoA conduisent à une inhibition de la rétroaction de la cétoacyl-CoA thiolase .
la β-oxydation des acides gras peut également se produire dans les peroxysomes. Chez les animaux, on pense que les peroxysomes jouent un rôle important dans la dégradation initiale des acides gras à très longue chaîne et des acides gras ramifiés par le méthyle . Les enzymes impliquées dans l’oxydation des acides gras dans les peroxysomes sont différentes des mitochondries., Une différence importante est l’acyl-CoA oxydase, la première enzyme de la β-oxydation du peroxysome, qui transfère L’hydrogène à l’oxygène produisant du H2O2 au lieu de produire du FADH2. Le H2O2 est décomposé en eau par catalase. Il est important de noter que les intermédiaires gras acyl-CoA formés lors de la β-oxydation sont les mêmes dans les peroxysomes et les mitochondries. Les peroxysomes contiennent également les enzymes nécessaires à l’α-oxydation, qui sont nécessaires à l’oxydation de certains acides gras avec des branches de méthyle.,
régulation transcriptionnelle de la β-oxydation des acides gras:
Les protéines impliquées dans la β-oxydation des acides gras sont régulées à la fois par des mécanismes transcriptionnels et post-transcriptionnels. Il existe un certain nombre de facteurs de transcription qui régulent l’expression de ces protéines. Les récepteurs activés par proliférateur de peroxisome (PPARs) et un coactivateur de facteur de transcription PGC-1α sont les régulateurs transcriptionnels les plus connus de β-oxydation d’acide gras . Les PPARs et le récepteur x rétinoïde hétérodimérisent et se lient aux promoteurs de gènes contenant L’élément de réponse PPAR ., Des exemples de protéines impliquées dans la β-oxydation des acides gras qui sont régulées transcriptionnellement par les PPARs comprennent FATP, acyl-CoA synthétase (ACS), CD36/FAT, MCD, CPT1, acyl-CoA déshydrogénase à longue chaîne (LCAD) et acyl-CoA déshydrogénase à chaîne moyenne (MCAD) . Le récepteur α (ERRa) lié aux œstrogènes a également été impliqué dans la régulation de la β-oxydation des acides gras, ayant été montré pour réguler également la transcription du gène codant le MCAD . Les Ligands qui se lient à et modulent L’activité de PPARa, δ Et γ comprennent les acides gras .,
Les gènes régulés par chacun des PPARs varient d’un type de tissu à l’autre. Par exemple, le muscle squelettique PPARδ, mais pas PPARa, régule à la hausse l’expression de CPT1 . Les isoformes PPAR sont également exprimées de manière différentielle entre les types de tissus . Tandis que la protéine de PPARδ tend à être ubiquitously exprimée, PPARa est principalement exprimée dans les tissus fortement métaboliques (c.-à-d. coeur, muscle squelettique, et foie) et PPARy est principalement exprimée dans les tissus tels que le tissu adipeux . Jusqu’à récemment, on ne croyait pas que le PPARy jouait un rôle important dans la régulation de la β-oxydation des acides gras., Cependant, des études récentes de knock-out et de surexpression ont suggéré que le PPARy pourrait avoir un rôle dans la régulation de la β-oxydation des acides gras. L’expression excessive de PPARy dans le muscle cardiaque entraîne une augmentation des niveaux d’ARNm pour les protéines d’oxydation β des acides gras .
Le Co-activateur transcriptionnel PGC-1α se lie et augmente l’activité des PPARs et des ERRa pour réguler la β-oxydation des acides gras . PGC – 1α module l’activité d’un certain nombre de facteurs de transcription qui peuvent augmenter l’expression des protéines impliquées dans la β-oxydation des acides gras, le cycle TCA et la chaîne de transport des électrons., Par exemple, l’augmentation de l’expression de la protéine PGC-1α induit une biogenèse mitochondriale massive dans le muscle squelettique .
PGC-1α est régulé à la fois au niveau du gène et de la protéine. AMPK augmente l’activité de la protéine PGC-1α préexistante par deux mécanismes proposés. La première consiste à phosphoryler PGC-1α sur les résidus de thréonine et de sérine, ce qui entraîne une augmentation globale de l’activité de PGC-1α . AMPK peut également augmenter l’activité de PGC-1α en activant la sirtuine 1 (SIRT1). SIRT1 peut alors désacétyler PGC-1α, augmentant son activité ., On pense que L’AMPK augmente les niveaux d’ARNm PGC-1α en régulant la liaison des facteurs de transcription à des séquences spécifiques situées dans le promoteur du gène PGC-1α qui comprennent deux sites MEF, un site d’élément de réponse à l’AMPc (CRE) et la région GATA/Ebox . AMPK régule les sites MEF en phosphorylant GEF, une protéine qui peut médier le mouvement de MEF2 dans le noyau . L’AMPK peut augmenter la liaison au site CRE par phosphorylation de la protéine de liaison de l’élément de réponse à l’AMPc (CREB) 1 et d’autres membres de la famille CREB qui se lient aux régions promotrices de la CRE ., Comme autre exemple, les acides gras libres peuvent également réguler L’expression de la protéine PGC-1α. Par exemple, un régime riche en graisses peut élever les niveaux de PGC-1α dans le muscle squelettique du rat .
Conclusions
La β-oxydation des acides gras est une voie métabolique majeure responsable de la dégradation mitochondriale de l’acyl-CoA à longue chaîne en acétyl-CoA. Ce processus implique de nombreuses étapes qui sont réglementées au niveau transcriptionnel et post-transcriptionnel., La régulation transcriptionnelle implique PPARs, SREBP1 et PGC-1α, tandis que le niveau post-transcriptionnel implique principalement le contrôle allostérique de la β–oxydation des acides gras, ainsi que la régulation ACC, MCD et CPT. Les deux mécanismes fonctionnent en harmonie pour assurer un approvisionnement continu en acyl-CoA à longue chaîne pour la β-oxydation, et en produits de β-oxydation pour la production d’énergie mitochondriale.
Remerciements: GDL est un scientifique de L’Alberta Heritage Foundation for Medical Research