Les molécules ou les ions qui peuvent donner ou accepter un proton, selon leur situation, sont appelés espèces amphiprotiques. L’espèce amphiprotique la plus importante est l’eau elle-même. Lorsqu’un acide donne un proton à l’eau, la molécule d’eau est un accepteur de proton, et donc une base. À l’inverse, lorsqu’une base réagit avec l’eau, une molécule d’eau donne un proton, et agit donc comme un acide.
un Autre groupe important de amphiprotic espèces sont les acides aminés., Chaque molécule d’acide aminé contient un groupe carboxyle acide et un groupe aminé basique. En fait, les acides aminés existent généralement sous forme de zwitterion (allemand pour « double ion”), où le proton a été transféré du carboxyle au groupe amino. Dans le cas de la glycine, par exemple, le zwitterion est
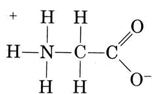
Le zwitterion peut donner un des protons du N, tout comme un ion NH4+ peut donner un proton. D’autre part, son COO– end peut accepter un proton, tout comme un CH3COO– ion peut., Other common amphiprotic species are HCO3–, H2PO4–, HPO42–, and other anions derived from diprotic or triprotic acids.