à la fin de la chimie gen, le calcul des États d’oxydation de différents métaux devrait être assez familier. Voici ce que vous faites. Prenez un composé typique – \(FeCl_3\), par exemple. Traiter tout lien entre le métal et un autre atome comme s’il s’agissait d’une liaison ionique. Cela signifie que les éléments les plus électronégatifs (comme le chlore, par exemple, ou l’oxygène) portent des charges négatives, et l’élément le moins électronégatif (comme le métal) porte la charge positive.,
Si le composé est neutre, la somme des états d’oxydation doit aussi être neutre. (Si le composé a une charge, vous ajustez les États d’oxydation en conséquence afin que leur somme soit égale à la charge).

Maintenant, voici un exercice amusant. Essayez d’appliquer les mêmes règles au carbone. Il va se sentir un peu bizarre. Pourquoi? Parce qu’il y a deux différences clés:
- premièrement, le carbone est souvent plus électronégatif (2.5) que certains des atomes auxquels il est lié (comme H, 2.2)., Alors, que faites-vous dans ce cas?
- Deuxièmement, contrairement aux liaisons métal-métal, les liaisons carbone-carbone sont omniprésentes. Comment procédez-vous avec eux?
Deux réponses.
- dans une liaison C-H, le H est traité comme s’il avait un État d’oxydation de +1. Cela signifie que chaque liaison C-H diminuera l’état d’oxydation du carbone de 1.
- deux liens entre le même atome n’affectent pas l’état d’oxydation (rappelons que l’état d’oxydation de Cl en Cl-Cl (et celle de H dans H-H) est égale à zéro. Ainsi, un carbone attaché à 4 carbones a un État d’oxydation de zéro.,
ainsi, contrairement aux métaux, qui sont presque toujours dans un État d’oxydation positif, l’état d’oxydation du carbone peut varier considérablement, de -4 (dans le CH4) à +4 (comme dans le CO2). Voici quelques exemples.
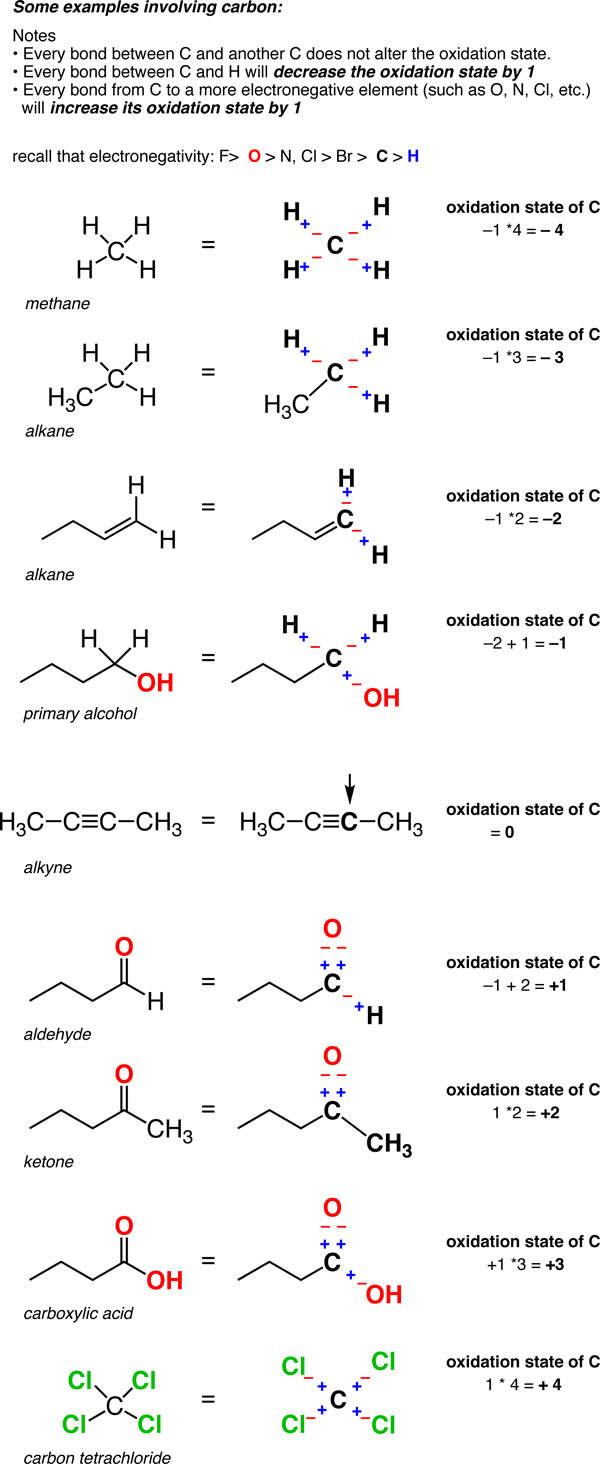
(N’oubliez pas que ce qui est appelé un « formalisme” pour une raison. La taxe sur le carbone n’est pas vraiment +4 ou -4. Mais le formalisme de l’état d’oxydation nous aide à garder une trace de l’endroit où vont les électrons, ce qui sera utile très bientôt).,
avec une compréhension de la façon de calculer les États d’oxydation sur le carbone, nous sommes prêts pour la prochaine étape: comprendre les changements dans l’état d’oxydation au carbone, par des réactions appelées oxydations (où l’état d’oxydation est augmenté), et réductions (où l’état d’oxydation est réduit). Plus sur que la prochaine fois.